四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题
四川
高二
期中
2022-10-26
132次
整体难度:
适中
考查范围:
化学反应原理、化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学实验基础
四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题
四川
高二
期中
2022-10-26
132次
整体难度:
适中
考查范围:
化学反应原理、化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 化学与社会、生活密切相关。下列说法正确的是
| A.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用硫酸除去 |
| B.含Cu2+、Pb2+等的电镀废液通常用调pH沉淀的方法除杂后再排放 |
| C.珊瑚和溶洞的形成,都与沉淀溶解平衡有关 |
| D.用硝酸或氨水都能清洗试管内的银镜,但原理不同 |
您最近一年使用:0次
2021-05-28更新
|
152次组卷
|
3卷引用:四川省绵阳东辰国际学校2020-2021学年高二下学期第一次月考化学试题
单选题
|
较易(0.85)
名校
2. 下列反应属于吸热反应的是
A.C6H12O6(葡萄糖aq)+6O2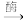 6CO2+6H2O 6CO2+6H2O |
| B.CH3COOH+KOH=CH3COOK+H2O |
| C.反应物的总能量大于生成物的总能量 |
| D.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量 |
您最近一年使用:0次
2016-12-09更新
|
144次组卷
|
8卷引用:2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题
(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2011-2012学年陕西师大附中高一下学期期中考试化学试卷(已下线)2013-2014湖南省株洲市二中高二上学期期末考试化学试卷2015-2016学年贵州省黔西南兴义天赋中学高二上第一次月考化学试卷吉林省白山市抚松六中2019-2020学年高二上学期第一次月考化学试卷广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 用NA表示阿伏加德罗常数,下列说法错误的是
| A.17g—OH与17gOH—所含电子数均为10NA |
| B.32g CH3OH中所含共价键数目为5NA |
| C.56g乙烯中所含共用电子对数目为12NA |
| D.52gNO2与40gN2O4的混合气体中含有的原子总数为6NA |
您最近一年使用:0次
2021-05-28更新
|
139次组卷
|
2卷引用:四川省绵阳东辰国际学校2020-2021学年高二下学期第一次月考化学试题
单选题
|
较难(0.4)
名校
解题方法
5. 25℃时,重水(D2O)的离子积为 1.6×10ˉ15,也可用与 pH 一样的定义来规定其酸碱度:pD=-lgc(D+),下列叙述正确的是(均为 25℃条件下)
| A.重水和水两种液体,D2O 的电离度大于 H2O |
| B.在 100mL0.25mol·Lˉ1DCl 重水溶液中,加入 50mL0.2mol·Lˉ1NaOD 重水溶液,反应后溶液的 pD=1 |
| C.0.01 mol·Lˉ1NaOD 重水溶液,其 pD=12 |
| D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·D2O 和 HD2O+ |
您最近一年使用:0次
2020-05-21更新
|
551次组卷
|
7卷引用:浙江省嘉兴市2020届高三年级教学质量评估化学试题
浙江省嘉兴市2020届高三年级教学质量评估化学试题四川省雅安中学2019-2020学年高二6月月考(期中)理综化学试题浙江省杭州高级中学2021届高三上学期期中考试化学试题(已下线)【浙江新东方】116湖北随州市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】高中化学20210513-042【2021】【高二下】四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
6. X、Y为同周期元素,如果X的原子半径大于Y,则下列说法不正确的是( )
| A.若X、Y均为金属元素,则X的金属性强于Y |
| B.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强 |
| C.若X、Y均为非金属元素,则Y的气态氢化物比X的稳定 |
| D.若X、Y均为非金属元素,则最高价氧化物所对应的水化物的酸性Y强于X |
【知识点】 元素周期律的应用 “位构性”关系理解及应用解读
您最近一年使用:0次
2019-04-01更新
|
89次组卷
|
2卷引用:四川省遂宁市第二中学2018-2019学年高一下学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 下列实验装置符合实验目的是( )
| 目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
| 装置 |  | 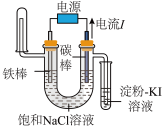 | 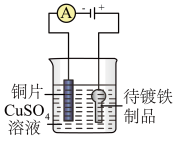 |  |
| 选项 | A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-26更新
|
814次组卷
|
21卷引用:2011-2012学年河南省许昌部分学校高二上学期期末联考化学试卷
(已下线)2011-2012学年河南省许昌部分学校高二上学期期末联考化学试卷(已下线)2011-2012学年江西省高安中学高二下学期期中考试化学试卷河北省邯郸大名一中2019-2020学年高二上学期第一次月考化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题内蒙古自治区集宁一中2019-2020学年高二上学期期中考试化学试题(已下线)2019年12月6日 《每日一题》人教版(选修4)——电镀铜与精炼铜的比较甘肃省天水市第一中学2019-2020学年高二上学期期末考试化学试题河南省平顶山市鲁山县第一高级中学2019-2020学年高二3月月考化学试题四川省雅安中学2019-2020学年高二6月月考(期中)理综化学试题吉林省长春市第一中学2019-2020学年高一下学期月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 章末综合检测卷吉林省长春市第七中学2020-2021学年高二上学期第一次月考化学试题内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题江苏省扬州中学2020-2021学年高二上学期12月月考化学试题山东省青岛市即墨区2020-2021学年高二上学期期中考试化学试题吉林省前郭尔罗斯蒙古族自治县蒙古族中学2020-2021学年高二上学期期末考试化学试题陕西省榆林市2021-2022学年高二上学期期末考试化学试题四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题
单选题
|
适中(0.65)
解题方法
8. 能正确表达下列反应的离子方程式为
A.用醋酸除去水垢: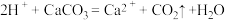 |
B. 溶液中滴入稀硫酸: 溶液中滴入稀硫酸: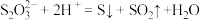 |
C.向足量的稀硝酸中加入少量铁粉: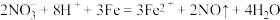 |
D.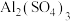 溶液中加入过量氨水: 溶液中加入过量氨水: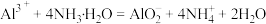 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
9. 有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质Y2O3-Na2O,允许O2-自由移动。下列叙述正确的是
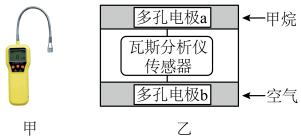

| A.瓦斯分析仪工作时,电池内电路中, O2-由电极a流向电极b |
| B.电池外电路中电子由正极流向负极 |
| C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
您最近一年使用:0次
2019-11-26更新
|
226次组卷
|
4卷引用:山东省平度市第九中学2019-2020学年高二上学期期中考试化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
10. 已知8NH3+3Cl2=6NH4Cl+N2,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):

(1)写出E中反应的化学方程式_____ 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式______________ 。
(3)D中干燥管中出现的现象是_______________ 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂______ 。
(5)通入D装置的两根导管左边较短、右边较长,目的是________________________

(1)写出E中反应的化学方程式
(2)B中出现黄色浑浊现象,产生此现象的离子方程式
(3)D中干燥管中出现的现象是
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂
(5)通入D装置的两根导管左边较短、右边较长,目的是
您最近一年使用:0次
2019-04-01更新
|
232次组卷
|
3卷引用:四川省遂宁市第二中学2018-2019学年高一下学期第一次月考化学试题
解答题-工业流程题
|
适中(0.65)
名校
11. 钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
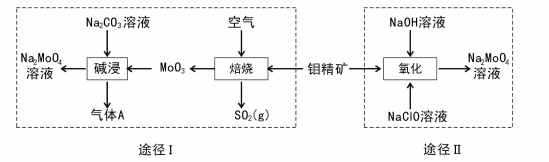
(l) Na2 MoO4 2H2O中钼元素的化合价为
2H2O中钼元素的化合价为____ ,NaCIO的电子式为 ___ 。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____ (答出两条即可)。
(3)途径I焙烧过程中化学方程式为____ ,碱浸时气体A的化学式为____ 。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____ (已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____ 。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____ 。

(l) Na2 MoO4
 2H2O中钼元素的化合价为
2H2O中钼元素的化合价为(2)途径I为了提高钼精矿焙烧速率,可采取的措施是
(3)途径I焙烧过程中化学方程式为
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为
您最近一年使用:0次
2019-04-03更新
|
338次组卷
|
4卷引用:内蒙古赤峰市宁城县2020届高三10月月考化学试题
内蒙古赤峰市宁城县2020届高三10月月考化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题(已下线)湖北省八校2019届高三3月第二次联考理综化学试题四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题
解答题-原理综合题
|
适中(0.65)
解题方法
12. 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g) △H<0;
(1)在恒容条件下该反应达到化学平衡状态的依据是_______ (选填序号)。
a.v(H2):v(N2)=3:1 b.气体的平均摩尔质量不变
c.气体的密度不变 d.容器内压强保持不变
(2)反应达到平衡后,某时刻改变下列条件_______ ,在达到新平衡的过程中正反应速率始终增大。
a.升温 b.加压 c.增大c(N2) d.降低c(NH3)
(3)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示(图中T2和T1表示温度,n表示起始时H2的物质的量):

①图象中T2和T1的关系:T2____ T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是_______ (填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为_______ mol•L﹣1。
(1)在恒容条件下该反应达到化学平衡状态的依据是
a.v(H2):v(N2)=3:1 b.气体的平均摩尔质量不变
c.气体的密度不变 d.容器内压强保持不变
(2)反应达到平衡后,某时刻改变下列条件
a.升温 b.加压 c.增大c(N2) d.降低c(NH3)
(3)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示(图中T2和T1表示温度,n表示起始时H2的物质的量):

①图象中T2和T1的关系:T2
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
13. 铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.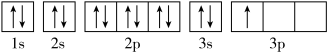
B.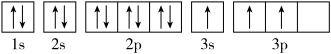
C.
D.
其中能量最低的是____ (填字母),电子由状态C到状态B所得原子光谱为____ 光谱(填“发射”或“吸收”) ,状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合_____ 。
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
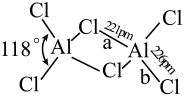
①a键的键能_____ b键的键能(填“>”“<”或“=”),其理由是_______ 。
②Al2Cl6中铝原子的杂化方式为___ ;AlCl3的空间结构为______ 。
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为_____ ,一个冰晶石晶胞中Na+的个数为_____ 。
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=____ pm(列出算式即可,阿伏伽德罗常数值为6.02×1023)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.

B.

C.

D.

其中能量最低的是
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。

①a键的键能
②Al2Cl6中铝原子的杂化方式为
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=
您最近一年使用:0次
2019-02-12更新
|
956次组卷
|
6卷引用:安徽师范大学附属中学2019届高三上学期1月测试理科综合化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学实验基础
试卷题型(共 13题)
题型
数量
单选题
9
解答题
3
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 沉淀溶解平衡的应用 沉淀的溶解与生成 沉淀转化 处理污水的几种方法 | |
| 2 | 0.85 | 吸热反应和放热反应 | |
| 3 | 0.85 | 反应热大小比较 | |
| 4 | 0.65 | 结合物质结构基础知识与NA相关推算 氢氧根与羟基的区别 醇的组成、结构 | |
| 5 | 0.4 | 水的离子积常数 水溶液中水的电离程度及的计算 pH定义式及计算 | |
| 6 | 0.65 | 元素周期律的应用 “位构性”关系理解及应用 | |
| 7 | 0.65 | 原电池概念及组成 氯碱工业 电镀 铜的电解精炼 | |
| 8 | 0.65 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 | |
| 9 | 0.65 | 烃燃料电池 | |
| 二、解答题 | |||
| 10 | 0.65 | 氯气的实验室制法 氯气与还原性化合物的反应 氨气的实验室制法 | 实验探究题 |
| 11 | 0.65 | 氧化还原反应方程式的配平 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 12 | 0.65 | 影响化学反应速率的因素 化学平衡图像分析 化学平衡状态的判断方法 转化率的相关计算及判断 | 原理综合题 |
| 三、填空题 | |||
| 13 | 0.85 | 物质结构与性质综合考查 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | |




 的关系表示正确的是
的关系表示正确的是





