真题
1 . 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL滴定中MnO4-被还原成Mn2+ 。重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL。
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______ 、转移、洗涤并转移、________ 摇匀。
② 加入锌粉的目的是________ 。
③ 写出步骤三中发生反应的离子方程式________ 。
④ 实验测得该晶体中铁的质量分数为__________ 。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________ 。(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________ ;_________ 。
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL滴定中MnO4-被还原成Mn2+ 。重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL。
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、
② 加入锌粉的目的是
③ 写出步骤三中发生反应的离子方程式
④ 实验测得该晶体中铁的质量分数为
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;
您最近一年使用:0次
2016-12-10更新
|
1187次组卷
|
3卷引用:2015-2016学年广西桂林十八学高二下期中化学试卷
13-14高三上·江苏泰州·期末
名校
2 . 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
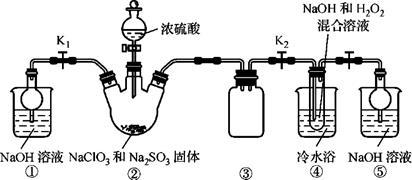
(1)装置③的作用是_________ 。
(2)装置②中产生ClO2的化学方程式为________________ ;装置④中制备NaClO2的化学方程式为_____________________ 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③___________ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为_____________ 。
(5)该样品中NaClO2的质量分数为_____ (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为__ 。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1)装置③的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
您最近一年使用:0次
2016-12-09更新
|
148次组卷
|
7卷引用:2016届广西钦州港经济技术开发区中学高三上学期期中测试化学试卷
2016届广西钦州港经济技术开发区中学高三上学期期中测试化学试卷(已下线)2013届江苏省泰州市高三上学期期末考试化学试卷(已下线)2013届天津市河东区高三第二次模拟考试理综化学试卷2015届陕西省西安市长安一中高三上学期第三次月考化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷西藏自治区拉萨中学2017届高三第八次月考理综化学试题
3 . 为测定硫酸亚铁铵晶体【(NH4)2Fe (SO4)2 · xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+。
再重复步骤二两次。
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、_____ 、转移、洗涤并转移、____ 、摇匀。
(2)用_____________ (“酸式”或“碱式”)滴定管盛放KMnO4溶液。
(3)当滴入最后一滴KMnO4溶液,出现______________________________ ,即到达滴定终点。反应的离子方程式:_________________________________________
(4)滴定结果如下表所示:
实验测得该晶体中铁的质量分数为_________ 。(保留两位小数)
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+。
再重复步骤二两次。
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、
(2)用
(3)当滴入最后一滴KMnO4溶液,出现
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
您最近一年使用:0次
2016-12-09更新
|
151次组卷
|
2卷引用:广西桂林市临桂区五通中学2021-2022学年高二下学期期中考试化学试题
4 . 常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是


| A.E溶液中存在:c(NH4+)>c(SO42-)> c(OH-)> c(H+) |
| B.稀硫酸的浓度为0.1mol/L |
| C.C点溶液pH=14-b |
| D.V2 =20mL |
您最近一年使用:0次
2016-12-09更新
|
247次组卷
|
2卷引用:2016届广西壮族自治区贺州市高三4月模拟考试理科化学试卷
2014高三·全国·专题练习
5 . 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
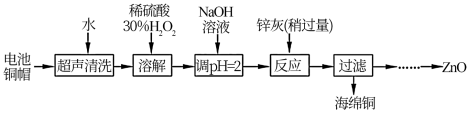
(1)①铜帽溶解时加入H 2 O 2 的目的是____________ (用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2 除去。除去H 2 O 2 的简便方法是___________ 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O +I 2 =2I-+S4O
+I 2 =2I-+S4O
①滴定选用的指示剂为_____ ,滴定终点观察到的现象为 ___________ 。
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会___________ (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①___________ ;② ___________ ;③过滤;④___________ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。

(1)①铜帽溶解时加入H 2 O 2 的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O
 +I 2 =2I-+S4O
+I 2 =2I-+S4O
①滴定选用的指示剂为
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
 | 1.1 | 3.2 |
 | 5.8 | 8.8 |
 | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①
您最近一年使用:0次
2016-12-09更新
|
772次组卷
|
5卷引用:广西钦州市钦州港经济技术开发区中学2017-2018学年高一上学期(12月)月考化学试题
11-12高三·浙江绍兴·阶段练习
名校
解题方法
6 . 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
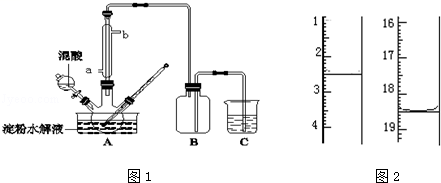
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________ ;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________ ;
(3)检验淀粉是否水解完全所用的试剂为_________ ;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________ ;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020mol•L﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________ ,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________ 。

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是
(3)检验淀粉是否水解完全所用的试剂为
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020mol•L﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为
您最近一年使用:0次
2016-12-09更新
|
1209次组卷
|
16卷引用:广西崇左市龙州县高级中学2019-2020学年高二上学期期末考试化学试题
广西崇左市龙州县高级中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区来宾市金秀县民族中学2019-2020学年高二上学期期末考试化学试题(已下线)2013届浙江省绍兴一中高三回头考试化学试卷云南省景东县民中2017-2018学年高二下学期6月份考试化学试题云南省文山马关实验高级中学2019-2020学年高二期末考试化学试题云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题云南省巧家县第三中学2019-2020学年高二上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高二上学期期末考试化学试题云南省丽江市玉龙县第一中学2019—2020学年高二上学期期末考试化学贵州省龙里中学2019-2020学年高二上学期期末考试化学试题贵州省黎平第二中学2019-2020学年高二上学期期末考试化学试题贵州省台江县第二中学2019-2020学年高二上学期期末考试化学试题贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高二上学期期末考试化学试题贵州省铜仁市沿河县第二高级中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市富源县第三中学2019-2020学年高二上学期期末考试化学试题四川省泸州市泸县第五中学2022-2023学年高二上学期12月月考试化学试题
11-12高二上·山西晋中·期中
名校
7 . 在100 mL某一元弱酸的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。
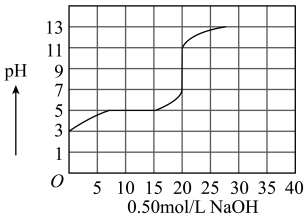
下列叙述正确的是( )

下列叙述正确的是( )
| A.该弱酸在滴定前的浓度是0.15 mol/L |
| B.该弱酸稀释10倍后pH为4 |
| C.滴定过程为求滴定终点,最合适的指示剂是酚酞 |
| D.滴定过程为求滴定终点,最合适的指示剂是甲基橙 |
您最近一年使用:0次
2016-12-09更新
|
580次组卷
|
8卷引用: 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷
11-12高二上·广西北海·期末
8 . 测定海水中溶解氧的步骤如下:
①水样的固定。取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应。
②酸化。开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞。反复振荡至沉淀完全溶解。
③滴定。向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH- =2MnO(OH)2 (该反应极快)
MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O
I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果_______ (填“偏高”或“偏低”或“无影响”)原因是__________________ 。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果________ (填“偏高”或“偏低”或“无影响”)原因是__________________ 。
(3)滴定前,未排除滴定管中的气泡。在滴定过程中气泡的排除,会使测定结果______ (填“偏高”或“偏低”或“无影响”)原因是_____________________ 。
①水样的固定。取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应。
②酸化。开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞。反复振荡至沉淀完全溶解。
③滴定。向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH- =2MnO(OH)2 (该反应极快)
MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O
I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果
(3)滴定前,未排除滴定管中的气泡。在滴定过程中气泡的排除,会使测定结果
您最近一年使用:0次



