名校
1 . 已知常温下水溶液中 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如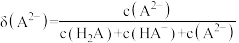 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中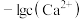 和
和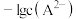 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
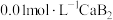 溶液,下列说法错误的是
溶液,下列说法错误的是
 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如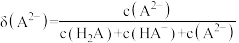 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中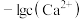 和
和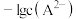 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
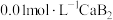 溶液,下列说法错误的是
溶液,下列说法错误的是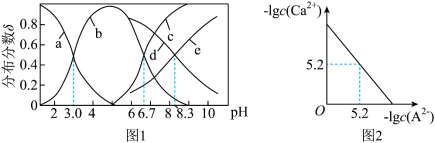
A.曲线b表示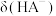 |
B. 溶液中存在: 溶液中存在: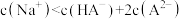 |
C.反应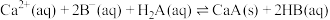 的平衡常数 的平衡常数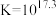 |
D.滴定过程中始终存在: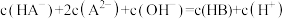 |
您最近一年使用:0次
7日内更新
|
125次组卷
|
2卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
解题方法
2 . 氮化铬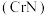 是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬
是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬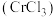 与氨气在高温下反应制备
与氨气在高温下反应制备 。
。
已知:① 的沸点是
的沸点是 ;②光气
;②光气 有毒,遇水生成
有毒,遇水生成 和
和
Ⅰ.制备无水氯化铬
反应原理为: 。相关实验装置如图(夹持装置略):
。相关实验装置如图(夹持装置略):
 .水浴加热并维持A的温度在
.水浴加热并维持A的温度在
 .打开
.打开 ,通入
,通入 并保证锥形瓶中每分钟有250个左右的气泡逸出
并保证锥形瓶中每分钟有250个左右的气泡逸出
 .点燃B处酒精喷灯,使瓷舟温度升至
.点燃B处酒精喷灯,使瓷舟温度升至 左右,反应一定时间
左右,反应一定时间
 .先后停止加热
.先后停止加热 ,冷却,并继续通入一段时间的
,冷却,并继续通入一段时间的
(1)C装置的名称是________________ 。
(2)A使用水浴加热的优点是_______________ 。
(3)D中反应的化学方程式为______________ 。
Ⅱ.制备氮化铬
某校化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略),其反应原理为:
已知: 易溶于水形成紫色的
易溶于水形成紫色的 离子,且易与水反应。
离子,且易与水反应。 装置是简易的氨气制备装置,导管
装置是简易的氨气制备装置,导管 的作用是
的作用是______________ 。
(5) 中盛放的试剂是
中盛放的试剂是__________ 。
(6)实验过程中需间歇性微热 处导管的目的是
处导管的目的是___________ 。
(7)请设计实验验证制得的 中是否含有
中是否含有
________________ 。
Ⅲ.测产品氮化铬的纯度
(8)向 所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用
所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用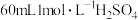 溶液完全吸收,剩余的硫酸用
溶液完全吸收,剩余的硫酸用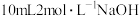 溶液恰好中和,则所得产品中氮化铬的纯度为
溶液恰好中和,则所得产品中氮化铬的纯度为_______________ 。
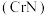 是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬
是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬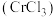 与氨气在高温下反应制备
与氨气在高温下反应制备 。
。已知:①
 的沸点是
的沸点是 ;②光气
;②光气 有毒,遇水生成
有毒,遇水生成 和
和
Ⅰ.制备无水氯化铬
反应原理为:
 。相关实验装置如图(夹持装置略):
。相关实验装置如图(夹持装置略):
 .水浴加热并维持A的温度在
.水浴加热并维持A的温度在
 .打开
.打开 ,通入
,通入 并保证锥形瓶中每分钟有250个左右的气泡逸出
并保证锥形瓶中每分钟有250个左右的气泡逸出 .点燃B处酒精喷灯,使瓷舟温度升至
.点燃B处酒精喷灯,使瓷舟温度升至 左右,反应一定时间
左右,反应一定时间 .先后停止加热
.先后停止加热 ,冷却,并继续通入一段时间的
,冷却,并继续通入一段时间的
(1)C装置的名称是
(2)A使用水浴加热的优点是
(3)D中反应的化学方程式为
Ⅱ.制备氮化铬
某校化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略),其反应原理为:

已知:
 易溶于水形成紫色的
易溶于水形成紫色的 离子,且易与水反应。
离子,且易与水反应。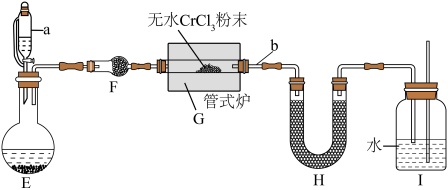
 装置是简易的氨气制备装置,导管
装置是简易的氨气制备装置,导管 的作用是
的作用是(5)
 中盛放的试剂是
中盛放的试剂是(6)实验过程中需间歇性微热
 处导管的目的是
处导管的目的是(7)请设计实验验证制得的
 中是否含有
中是否含有
Ⅲ.测产品氮化铬的纯度
(8)向
 所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用
所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用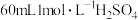 溶液完全吸收,剩余的硫酸用
溶液完全吸收,剩余的硫酸用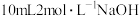 溶液恰好中和,则所得产品中氮化铬的纯度为
溶液恰好中和,则所得产品中氮化铬的纯度为
您最近一年使用:0次
3 . 二氯化二硫( )用于橡胶的低温硫化剂和黏合剂,在冶金工业中用作金、银等贵稀金属的萃取剂。请回答下列问题:
)用于橡胶的低温硫化剂和黏合剂,在冶金工业中用作金、银等贵稀金属的萃取剂。请回答下列问题:
已知:① ,
, ;
;
②常温下, 是一种浅黄色的油状液体,易挥发,在空气中可剧烈水解,产生白雾并伴有刺激性气味;
是一种浅黄色的油状液体,易挥发,在空气中可剧烈水解,产生白雾并伴有刺激性气味;
③相关物质的熔、沸点如下表:
I. 的制备
的制备___________
(2)实验操作的先后顺序:组装仪器并检验装置的气密性,加入药品;打开 、
、 、
、 ,通入氮气,通氮气的目的是
,通入氮气,通氮气的目的是___________ ;通冷凝水,___________ (填实验操作,下同),加热装置C使三颈烧瓶中的硫黄熔化,滴加浓盐酸,继续加热装置C至135~140℃;一段时间后停止滴加浓盐酸,___________ ,最后在装置D中收集到浅黄色液体。
(3)装置G的作用为___________
(4)装置D中水浴温度应控制在略高于59℃,其目的是___________ 。
Ⅱ.测定 产品的纯度(杂质不参与反应)
产品的纯度(杂质不参与反应)
向mg样品中加入适量蒸馏水,加热蒸出全部气体,用足量的 溶液充分吸收,以酚酞作指示剂(亚硫酸钠溶液的pH在指示剂变色范围内),再用
溶液充分吸收,以酚酞作指示剂(亚硫酸钠溶液的pH在指示剂变色范围内),再用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 ,达到滴定终点时消耗
,达到滴定终点时消耗 标准溶液的体积为
标准溶液的体积为 。
。
对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗 标准溶液的体积为
标准溶液的体积为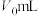 。
。
(5)样品纯度为___________ (用含c、m、 、
、 的代数式表示)。
的代数式表示)。
 )用于橡胶的低温硫化剂和黏合剂,在冶金工业中用作金、银等贵稀金属的萃取剂。请回答下列问题:
)用于橡胶的低温硫化剂和黏合剂,在冶金工业中用作金、银等贵稀金属的萃取剂。请回答下列问题:已知:①
 ,
, ;
;②常温下,
 是一种浅黄色的油状液体,易挥发,在空气中可剧烈水解,产生白雾并伴有刺激性气味;
是一种浅黄色的油状液体,易挥发,在空气中可剧烈水解,产生白雾并伴有刺激性气味;③相关物质的熔、沸点如下表:
| 物质 |  |  |  |
| 熔点/℃ | 112.8 | -77 | -121 |
| 沸点/℃ | 444.6 | 137 | 59 |
 的制备
的制备
(2)实验操作的先后顺序:组装仪器并检验装置的气密性,加入药品;打开
 、
、 、
、 ,通入氮气,通氮气的目的是
,通入氮气,通氮气的目的是(3)装置G的作用为
(4)装置D中水浴温度应控制在略高于59℃,其目的是
Ⅱ.测定
 产品的纯度(杂质不参与反应)
产品的纯度(杂质不参与反应)向mg样品中加入适量蒸馏水,加热蒸出全部气体,用足量的
 溶液充分吸收,以酚酞作指示剂(亚硫酸钠溶液的pH在指示剂变色范围内),再用
溶液充分吸收,以酚酞作指示剂(亚硫酸钠溶液的pH在指示剂变色范围内),再用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 ,达到滴定终点时消耗
,达到滴定终点时消耗 标准溶液的体积为
标准溶液的体积为 。
。对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗
 标准溶液的体积为
标准溶液的体积为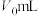 。
。(5)样品纯度为
 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
4 . EDTA(乙二胺四乙酸)是一种重要的络合剂,其结构简式为 (可简写为
(可简写为 )。某实验小组以一氯乙酸(
)。某实验小组以一氯乙酸( )和乙二胺(
)和乙二胺( )等为原料合成EDTA并测定饮用水的硬度。步骤如下:
)等为原料合成EDTA并测定饮用水的硬度。步骤如下:
 溶液至不再产生气泡为止。
溶液至不再产生气泡为止。步骤Ⅱ:向三颈烧瓶中继续加入15.60g乙二胺,摇匀,放置片刻,加入
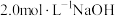 溶液90mL,加水至总体积为400mL左右,装上空气冷却回流装置,于50℃水浴上保温2h,再于沸水浴上保温回流4h。
溶液90mL,加水至总体积为400mL左右,装上空气冷却回流装置,于50℃水浴上保温2h,再于沸水浴上保温回流4h。步骤Ⅲ:取下三颈烧瓶,将混合物冷却后倒入烧杯中,加入活性炭,搅拌、过滤。
步骤Ⅳ:用浓盐酸调节pH至1.2,有白色沉淀生成,抽滤得EDTA粗品。
请回答下列问题:
(1)三颈烧瓶最适宜的规格为
(2)写出步骤Ⅰ中反应的化学方程式:
(3)步骤Ⅱ中需要配制
 溶液,下列操作中正确的是
溶液,下列操作中正确的是操作 |
|
|
|
|
选项 | a | b | c | d |
(4)使用活性炭的作用是脱色,一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是
(5)步骤Ⅳ中若选用试纸控制pH,应选用
(6)用
 溶液测定饮用水的总硬度。取饮用水样品250mL,加入掩蔽剂排除干扰、调节pH等预处理后,用
溶液测定饮用水的总硬度。取饮用水样品250mL,加入掩蔽剂排除干扰、调节pH等预处理后,用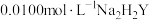 标准溶液进行测定。测定中涉及的反应有:
标准溶液进行测定。测定中涉及的反应有: (蓝色)
(蓝色) (酒红色)
(酒红色)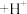 、
、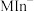 (酒红色)
(酒红色) (蓝色)
(蓝色)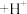 、
、 [
[ 代表
代表 、
、 ;铬黑
;铬黑 为指示剂]。
为指示剂]。①确认达到滴定终点的标志是
②平行实验三次,滴定终点时共消耗
 溶液的平均值为20.00mL,则该饮用水的硬度=
溶液的平均值为20.00mL,则该饮用水的硬度= 和
和 都看作
都看作 ,并将其折算成CaO的质量,通常把1L水中含有10mgCaO称为1度)。
,并将其折算成CaO的质量,通常把1L水中含有10mgCaO称为1度)。
您最近一年使用:0次
2024-06-02更新
|
158次组卷
|
3卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
名校
5 . 三草酸合铁( )酸钾晶体
)酸钾晶体 (
(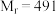 ),
), 时在水中溶解度为
时在水中溶解度为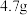 ,
, 时溶解度为
时溶解度为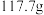 ,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备
,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备 (夹持装置略去),后续再制取三草酸合铁(
(夹持装置略去),后续再制取三草酸合铁( )酸钾晶体。
)酸钾晶体。
实验一: 晶体的制备
晶体的制备
(1)打开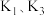 和
和 ,关闭
,关闭 ,向装置
,向装置 中加入稍过量的稀硫酸。
中加入稍过量的稀硫酸。
① 中盛放
中盛放 溶液的仪器名称为
溶液的仪器名称为___________ 。
②A中有气体产生,该气体的作用是___________ 。
(2)收集 并验纯后,打开
并验纯后,打开 ,关闭
,关闭___________ ,让A中浅绿色溶液流入 中,以生成
中,以生成 ,并分离得
,并分离得 晶体。
晶体。
实验二:三草酸合铁( )酸钾晶体的制备
)酸钾晶体的制备
(3)将实验一得到的 溶于水,加入
溶于水,加入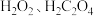 和
和 ,酒精灯微热并不断搅拌,反应制得
,酒精灯微热并不断搅拌,反应制得 ,冷却、过滤、洗涤、干燥。
,冷却、过滤、洗涤、干燥。
①写出该反应的化学方程式:___________ 。
②“微热、搅拌”过程中,温度不宜过高的原因是___________ 。
③过滤后需用___________ 洗涤,其优点是___________ 。
(4)产品纯度的测定
常温下,取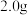 三草酸合铁(Ⅲ)酸钾晶体溶于水配制成
三草酸合铁(Ⅲ)酸钾晶体溶于水配制成 绿色溶液,取出25.00mL,用
绿色溶液,取出25.00mL,用 的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
①滴定终点的判断依据是___________ 。
②该三草酸合铁( )酸钾晶体的纯度为
)酸钾晶体的纯度为___________ (保留三位有效数字)。
 )酸钾晶体
)酸钾晶体 (
( ),
), 时在水中溶解度为
时在水中溶解度为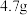 ,
, 时溶解度为
时溶解度为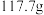 ,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备
,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备 (夹持装置略去),后续再制取三草酸合铁(
(夹持装置略去),后续再制取三草酸合铁( )酸钾晶体。
)酸钾晶体。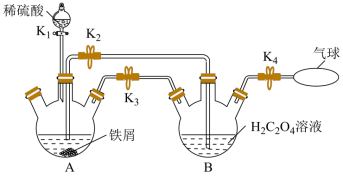
实验一:
 晶体的制备
晶体的制备(1)打开
 和
和 ,关闭
,关闭 ,向装置
,向装置 中加入稍过量的稀硫酸。
中加入稍过量的稀硫酸。①
 中盛放
中盛放 溶液的仪器名称为
溶液的仪器名称为②A中有气体产生,该气体的作用是
(2)收集
 并验纯后,打开
并验纯后,打开 ,关闭
,关闭 中,以生成
中,以生成 ,并分离得
,并分离得 晶体。
晶体。实验二:三草酸合铁(
 )酸钾晶体的制备
)酸钾晶体的制备(3)将实验一得到的
 溶于水,加入
溶于水,加入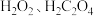 和
和 ,酒精灯微热并不断搅拌,反应制得
,酒精灯微热并不断搅拌,反应制得 ,冷却、过滤、洗涤、干燥。
,冷却、过滤、洗涤、干燥。①写出该反应的化学方程式:
②“微热、搅拌”过程中,温度不宜过高的原因是
③过滤后需用
(4)产品纯度的测定
常温下,取
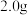 三草酸合铁(Ⅲ)酸钾晶体溶于水配制成
三草酸合铁(Ⅲ)酸钾晶体溶于水配制成 绿色溶液,取出25.00mL,用
绿色溶液,取出25.00mL,用 的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。①滴定终点的判断依据是
②该三草酸合铁(
 )酸钾晶体的纯度为
)酸钾晶体的纯度为
您最近一年使用:0次
6 . 常温下,在特制容器中加入20mL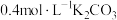 溶液,用
溶液,用 HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
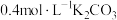 溶液,用
溶液,用 HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
A.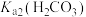 的数量级为 的数量级为 |
| B.滴定过程中,水的电离程度始终在减小 |
C.cd段反应的离子方程式为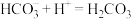 |
D.f点对应的溶液中存在: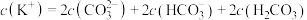 |
您最近一年使用:0次
2024-05-29更新
|
84次组卷
|
2卷引用:广西壮族自治区玉林市五校2023-2024学年高二下学期5月联考 化学试题
解题方法
7 . 硫脲( )可用作橡胶的硫化促进剂、金属矿物的浮选剂。已知硫脲易溶于水,在空气中易被氧化,受热时部分发生异构化反应而生成硫氰化铵(
)可用作橡胶的硫化促进剂、金属矿物的浮选剂。已知硫脲易溶于水,在空气中易被氧化,受热时部分发生异构化反应而生成硫氰化铵( )。实验室制备硫脲的装置如图所示(夹持和加热装置略)。
)。实验室制备硫脲的装置如图所示(夹持和加热装置略)。

(1)仪器a的名称是
(2)反应开始时,先打开
 ,当观察到装置C中出现黑色沉淀时,再打开
,当观察到装置C中出现黑色沉淀时,再打开 ,这样操作的目的是
,这样操作的目的是(3)装置B中除生成硫脲外,还生成一种碱,写出装置B中发生反应的化学方程式:
(4)装置B反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用
 酸性
酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL(已知滴定时,硫脲转化为
标准溶液滴定,滴定至终点时消耗标准溶液VmL(已知滴定时,硫脲转化为 、
、 和
和 ,假设杂质不参与反应)。
,假设杂质不参与反应)。①该实验中滴加酸性
 标准溶液的正确操作是
标准溶液的正确操作是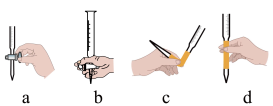
 、V的代数式表示)。
、V的代数式表示)。③若滴定前平视酸性
 标准溶液液面读数,滴定后俯视液面读数,计算得到的待测产品纯度比实际纯度
标准溶液液面读数,滴定后俯视液面读数,计算得到的待测产品纯度比实际纯度
您最近一年使用:0次
名校
8 . 25℃,用0.1 的NaOH溶液滴定某二元弱酸
的NaOH溶液滴定某二元弱酸 ,pH、粒子的分布分数
,pH、粒子的分布分数 [如
[如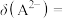
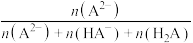 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的NaOH溶液滴定某二元弱酸
的NaOH溶液滴定某二元弱酸 ,pH、粒子的分布分数
,pH、粒子的分布分数 [如
[如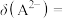
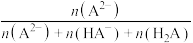 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是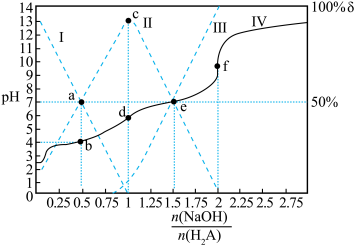
A.Ⅱ线表示的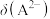 变化曲线 变化曲线 |
B.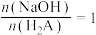 时, 时,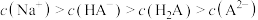 |
C. 时, 时,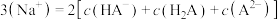 |
| D.a、b,c、d、e、f六点溶液中,f中水的电离程度最大 |
您最近一年使用:0次
2024-05-14更新
|
150次组卷
|
2卷引用:广西桂林市2024届高三下学期第三次模拟考试(三模)化学试卷
解题方法
9 . 富马酸亚铁[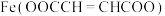 ,
,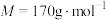 ]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
Ⅰ.制备富马酸亚铁
步骤1:将4.64g富马酸(HOOCCH=CHCOOH)固体置于100mL烧杯中,加水20mL,在加热搅拌下加入 溶液10mL,使其pH为6.5~6.7,
溶液10mL,使其pH为6.5~6.7,
步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通 并加热一段时间后,缓慢滴加40mL
并加热一段时间后,缓慢滴加40mL 的
的 溶液,维持温度100℃,搅拌充分反应1.5h;
溶液,维持温度100℃,搅拌充分反应1.5h;
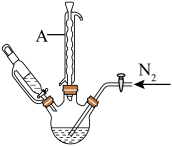
步骤3:将反应混合液冷却后,通过一系列操作,得到粗产品3.06g。
Ⅱ.纯度分析
取mg样品配制成100mL溶液,取25mL置于250mL锥形瓶中,加入煮沸过的 硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇
硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色);立即用
呈无色);立即用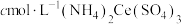 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为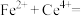
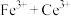 )。平行测定三次,消耗标准溶液的平均体积为VmL。
)。平行测定三次,消耗标准溶液的平均体积为VmL。
(1)仪器A的名称是______ 。
(2)“步骤1”中发生反应的方程式为______ ,pH调节不能过高,其原因是______ 。
(3)“步骤2”中持续通入 的目的是
的目的是______ 。
(4)“步骤3”一系列操作是指减压过滤,______ ,干燥等过程。证明富马酸亚铁产品已洗涤干净的实验操作及现象是______ 。
(5)纯度分析实验中判断达到滴定终点的现象是______ 。
(6)测得产品的纯度为______ 。(用含m、c、V的代数式表示)
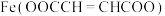 ,
,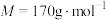 ]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。Ⅰ.制备富马酸亚铁
步骤1:将4.64g富马酸(HOOCCH=CHCOOH)固体置于100mL烧杯中,加水20mL,在加热搅拌下加入
 溶液10mL,使其pH为6.5~6.7,
溶液10mL,使其pH为6.5~6.7,步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通
 并加热一段时间后,缓慢滴加40mL
并加热一段时间后,缓慢滴加40mL 的
的 溶液,维持温度100℃,搅拌充分反应1.5h;
溶液,维持温度100℃,搅拌充分反应1.5h;
步骤3:将反应混合液冷却后,通过一系列操作,得到粗产品3.06g。
Ⅱ.纯度分析
取mg样品配制成100mL溶液,取25mL置于250mL锥形瓶中,加入煮沸过的
 硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇
硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色);立即用
呈无色);立即用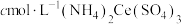 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为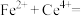
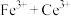 )。平行测定三次,消耗标准溶液的平均体积为VmL。
)。平行测定三次,消耗标准溶液的平均体积为VmL。(1)仪器A的名称是
(2)“步骤1”中发生反应的方程式为
(3)“步骤2”中持续通入
 的目的是
的目的是(4)“步骤3”一系列操作是指减压过滤,
(5)纯度分析实验中判断达到滴定终点的现象是
(6)测得产品的纯度为
您最近一年使用:0次
名校
解题方法
10 . 我国的歼-20战机使用了大量的钛金属,四氯化钛是生产海绵钛的重要中间原料,某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。
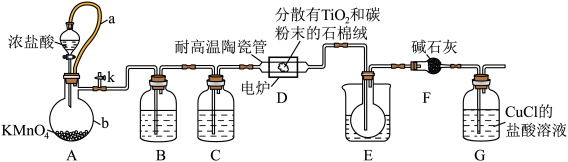
已知:① 的盐酸溶液可以与CO反应;
的盐酸溶液可以与CO反应;
②有关物质的性质。
请回答下列问题:
(1)仪器b的名称为_______ 。
(2)装置C中的药品为_______ ,装置G的作用为_______ 。
(3)组装好仪器后,部分实验步骤如下:①装入药品 ②打开分液漏斗活塞 ③检查装置气密性 ④关闭分液漏斗活塞 ⑤停止加热,充分冷却 ⑥加热装置D中陶瓷管。从上述选项选择合适操作(不重复使用)并排序:③①_______ (填序号)。
(4)装置D中发生两个反应,其中副反应为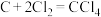 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式_______ 。
(5)进一步提纯E中产物的方法是_______ 。
(6)测定 的含量:取
的含量:取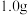 产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成
产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成 溶液。取
溶液。取 于锥形瓶中,滴加2~3滴
于锥形瓶中,滴加2~3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液 。该产品纯度为
。该产品纯度为_______ 。下列实验操作会导致产品纯度测定结果偏低的有_______ 。
A.未用标准液润洗滴定管 B.未将安全漏斗中的液体转移到容量瓶中
C.滴定终点时仰视读数 D.滴加过多的 溶液
溶液
 (夹持装置略去)。
(夹持装置略去)。
已知:①
 的盐酸溶液可以与CO反应;
的盐酸溶液可以与CO反应;②有关物质的性质。
| 熔点/℃ | 沸点/℃ | 密度/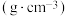 | 水溶性 | |
 |  | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
 | 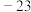 | 76.8 | 1.6 | 难溶于水 |
(1)仪器b的名称为
(2)装置C中的药品为
(3)组装好仪器后,部分实验步骤如下:①装入药品 ②打开分液漏斗活塞 ③检查装置气密性 ④关闭分液漏斗活塞 ⑤停止加热,充分冷却 ⑥加热装置D中陶瓷管。从上述选项选择合适操作(不重复使用)并排序:③①
(4)装置D中发生两个反应,其中副反应为
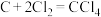 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式(5)进一步提纯E中产物的方法是
(6)测定
 的含量:取
的含量:取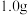 产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成
产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成 溶液。取
溶液。取 于锥形瓶中,滴加2~3滴
于锥形瓶中,滴加2~3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液 。该产品纯度为
。该产品纯度为
A.未用标准液润洗滴定管 B.未将安全漏斗中的液体转移到容量瓶中
C.滴定终点时仰视读数 D.滴加过多的
 溶液
溶液
您最近一年使用:0次







