名校
1 . 25℃,用0.1 的NaOH溶液滴定某二元弱酸
的NaOH溶液滴定某二元弱酸 ,pH、粒子的分布分数
,pH、粒子的分布分数 [如
[如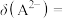
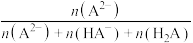 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的NaOH溶液滴定某二元弱酸
的NaOH溶液滴定某二元弱酸 ,pH、粒子的分布分数
,pH、粒子的分布分数 [如
[如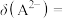
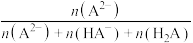 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是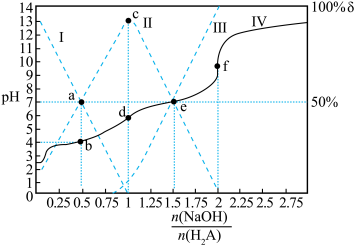
A.Ⅱ线表示的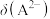 变化曲线 变化曲线 |
B.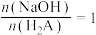 时, 时,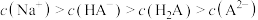 |
C. 时, 时,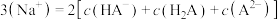 |
| D.a、b,c、d、e、f六点溶液中,f中水的电离程度最大 |
您最近一年使用:0次
2024-05-14更新
|
115次组卷
|
2卷引用:广西桂林市2024届高三下学期第三次模拟考试(三模)化学试卷
名校
解题方法
2 . 四氯化锡( 熔点为-33℃,沸点为114℃,易水解生成固体
熔点为-33℃,沸点为114℃,易水解生成固体 )可用于分析试剂,有机合成脱水剂,可由熔融态的金属锡(
)可用于分析试剂,有机合成脱水剂,可由熔融态的金属锡( ,熔点为231℃)在300℃左右与氯气作用制得,利用如图所示装置制备无水
,熔点为231℃)在300℃左右与氯气作用制得,利用如图所示装置制备无水 (夹持和控温装置省略):
(夹持和控温装置省略):
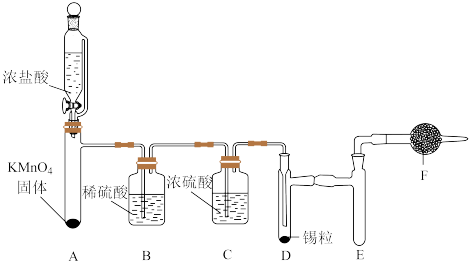
回答下列问题
(1)盛装浓盐酸的仪器名称是________ 。
(2) 装置的作用是
装置的作用是________ ,若无 装置对实验有何影响?请用化学方程式表示
装置对实验有何影响?请用化学方程式表示________ 。
(3)实验开始时,先向 试管中加入浓盐酸,待
试管中加入浓盐酸,待________ 时开始加热 试管;为使
试管;为使 装置起到良好效果,对
装置起到良好效果,对 装置进行的操作为
装置进行的操作为________ 。
(4)可用 测定产品中
测定产品中 含量以判断产品的纯度,取
含量以判断产品的纯度,取 装置中的产品,经过处理后配成
装置中的产品,经过处理后配成 溶液,用
溶液,用________ (填仪器名称)取出 放入锥形瓶中,加入二甲酚橙作指示剂,用
放入锥形瓶中,加入二甲酚橙作指示剂,用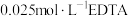 标准液进行滴定,达到滴定终点时消耗
标准液进行滴定,达到滴定终点时消耗 标准液
标准液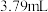 (定量关系:
(定量关系: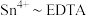 ),则产品纯度为
),则产品纯度为________ (精确到小数点后两位),若滴定管规格为 ,样品溶液起始读数为
,样品溶液起始读数为 ,此时滴定管中样品溶液的实际体积为
,此时滴定管中样品溶液的实际体积为________ 。(填序号)
A. B.
B. C.大于
C.大于 D.小于
D.小于
 熔点为-33℃,沸点为114℃,易水解生成固体
熔点为-33℃,沸点为114℃,易水解生成固体 )可用于分析试剂,有机合成脱水剂,可由熔融态的金属锡(
)可用于分析试剂,有机合成脱水剂,可由熔融态的金属锡( ,熔点为231℃)在300℃左右与氯气作用制得,利用如图所示装置制备无水
,熔点为231℃)在300℃左右与氯气作用制得,利用如图所示装置制备无水 (夹持和控温装置省略):
(夹持和控温装置省略):
回答下列问题
(1)盛装浓盐酸的仪器名称是
(2)
 装置的作用是
装置的作用是 装置对实验有何影响?请用化学方程式表示
装置对实验有何影响?请用化学方程式表示(3)实验开始时,先向
 试管中加入浓盐酸,待
试管中加入浓盐酸,待 试管;为使
试管;为使 装置起到良好效果,对
装置起到良好效果,对 装置进行的操作为
装置进行的操作为(4)可用
 测定产品中
测定产品中 含量以判断产品的纯度,取
含量以判断产品的纯度,取 装置中的产品,经过处理后配成
装置中的产品,经过处理后配成 溶液,用
溶液,用 放入锥形瓶中,加入二甲酚橙作指示剂,用
放入锥形瓶中,加入二甲酚橙作指示剂,用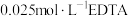 标准液进行滴定,达到滴定终点时消耗
标准液进行滴定,达到滴定终点时消耗 标准液
标准液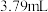 (定量关系:
(定量关系: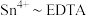 ),则产品纯度为
),则产品纯度为 ,样品溶液起始读数为
,样品溶液起始读数为 ,此时滴定管中样品溶液的实际体积为
,此时滴定管中样品溶液的实际体积为A.
 B.
B. C.大于
C.大于 D.小于
D.小于
您最近一年使用:0次
解题方法
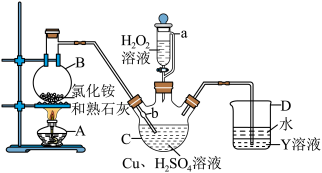
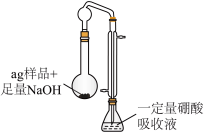
3 . 硫酸四氨合铜晶体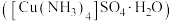 常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和
常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和 反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
一、硫酸四氨合铜的制备
(1)仪器 的名称是
的名称是_____________ ;球泡 的作用是
的作用是_____________ ; 中的
中的 液体可以为
液体可以为_________ (填化学式)。
(2)装置 中得到深蓝色溶液的总反应的离子方程式为
中得到深蓝色溶液的总反应的离子方程式为______________________ 。
(3)反应后取下仪器甲,向其中缓缓加入 乙醇、抽滤、洗涤得到
乙醇、抽滤、洗涤得到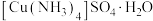 晶体,采用抽滤的原因是
晶体,采用抽滤的原因是______________________ 。
二、测定制备样品中氨的含量
步骤:按如图所示装置进行实验(药品及用量已标出;加热、夹持等装置已略去;硼酸极弱,仅作吸收剂,不影响盐酸标定氨的实验结果),维持沸腾一小时,取下锥形瓶,加入指示剂进行滴定操作,到达滴定终点时,消耗 的盐酸溶液
的盐酸溶液 。
。
(4)指示剂为_____________ 。
(5)该晶体的纯度为_____________________  。
。
(6)下列实验操作可能使氨含量测定结果偏低的原因是 。
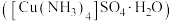 常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和
常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和 反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:一、硫酸四氨合铜的制备

(1)仪器
 的名称是
的名称是 的作用是
的作用是 中的
中的 液体可以为
液体可以为(2)装置
 中得到深蓝色溶液的总反应的离子方程式为
中得到深蓝色溶液的总反应的离子方程式为(3)反应后取下仪器甲,向其中缓缓加入
 乙醇、抽滤、洗涤得到
乙醇、抽滤、洗涤得到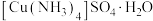 晶体,采用抽滤的原因是
晶体,采用抽滤的原因是二、测定制备样品中氨的含量
步骤:按如图所示装置进行实验(药品及用量已标出;加热、夹持等装置已略去;硼酸极弱,仅作吸收剂,不影响盐酸标定氨的实验结果),维持沸腾一小时,取下锥形瓶,加入指示剂进行滴定操作,到达滴定终点时,消耗
 的盐酸溶液
的盐酸溶液 。
。
(4)指示剂为
(5)该晶体的纯度为
 。
。(6)下列实验操作可能使氨含量测定结果偏低的原因是 。
A.滴定时未用 标准溶液润洗滴定管 标准溶液润洗滴定管 | B.滴定前滴定管内无气泡,滴定后有气泡 |
| C.读数时,滴定前俯视,滴定后仰视 | D.刚看到指示剂局部的颜色变化就停止滴定 |
您最近一年使用:0次
解题方法
4 . 某实验小组模拟工业制备碘酸钾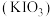 并测定
并测定 纯度的过程如下:
纯度的过程如下:
I.制备碘酸钾[实验装置如图(夹持装置已省略)]
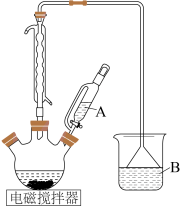
步骤1:向三颈烧瓶中依次加入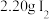 、
、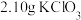 和
和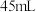 水,向仪器A中加入
水,向仪器A中加入 盐酸,充分反应直至反应结束。
盐酸,充分反应直至反应结束。
步骤2:将步骤1所得溶液转入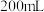 烧杯中,加30%的
烧杯中,加30%的 溶液调节pH至10,通过一系列操作后得到含
溶液调节pH至10,通过一系列操作后得到含 的产品。
的产品。
回答下列问题:
(1)仪器A的名称为___________ 。
(2)反应结束后,三颈烧瓶中的产物是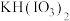 和
和 等,则步骤1反应的化学方程式为
等,则步骤1反应的化学方程式为___________ 。
(3)B装置的作用是___________ 。
(4)当观察到三颈烧瓶中溶液的___________ 色褪去时,可判断步骤1的反应结束。
Ⅱ.测定产品中的纯度
(5)测定方案:准确称取a g产品,配制成 溶液作为待测液,取
溶液作为待测液,取 该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处
该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处 ,当溶液呈淡黄色时,加入少许指示剂,用
,当溶液呈淡黄色时,加入少许指示剂,用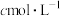 的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中
的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中 的纯度。已知:
的纯度。已知: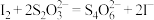 。
。
①滴定前,下列有关滴定管的操作顺序依次为___________ (填字母)。。
a.装入滴定液至零刻度线以上 b.用蒸馏水洗涤
c.调整滴定液液面至零刻度线或零刻度线以下 d.检查是否漏水
e.排除气泡 f.用滴定液润洗2~3次
g.记录起始读数,开始滴定
②测定方案中的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞的主要目的是___________ 。
③若平行滴定三次,达到滴定终点时消耗 标准溶液的平均体积为V mL,产品中碘酸钾的纯度为
标准溶液的平均体积为V mL,产品中碘酸钾的纯度为___________ (用含a、c、V的表达式表示)。
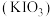 并测定
并测定 纯度的过程如下:
纯度的过程如下:I.制备碘酸钾[实验装置如图(夹持装置已省略)]

步骤1:向三颈烧瓶中依次加入
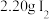 、
、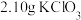 和
和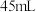 水,向仪器A中加入
水,向仪器A中加入 盐酸,充分反应直至反应结束。
盐酸,充分反应直至反应结束。步骤2:将步骤1所得溶液转入
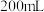 烧杯中,加30%的
烧杯中,加30%的 溶液调节pH至10,通过一系列操作后得到含
溶液调节pH至10,通过一系列操作后得到含 的产品。
的产品。回答下列问题:
(1)仪器A的名称为
(2)反应结束后,三颈烧瓶中的产物是
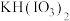 和
和 等,则步骤1反应的化学方程式为
等,则步骤1反应的化学方程式为(3)B装置的作用是
(4)当观察到三颈烧瓶中溶液的
Ⅱ.测定产品中的纯度
(5)测定方案:准确称取a g产品,配制成
 溶液作为待测液,取
溶液作为待测液,取 该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处
该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处 ,当溶液呈淡黄色时,加入少许指示剂,用
,当溶液呈淡黄色时,加入少许指示剂,用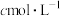 的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中
的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中 的纯度。已知:
的纯度。已知: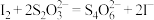 。
。①滴定前,下列有关滴定管的操作顺序依次为
a.装入滴定液至零刻度线以上 b.用蒸馏水洗涤
c.调整滴定液液面至零刻度线或零刻度线以下 d.检查是否漏水
e.排除气泡 f.用滴定液润洗2~3次
g.记录起始读数,开始滴定
②测定方案中的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞的主要目的是
③若平行滴定三次,达到滴定终点时消耗
 标准溶液的平均体积为V mL,产品中碘酸钾的纯度为
标准溶液的平均体积为V mL,产品中碘酸钾的纯度为
您最近一年使用:0次
名校
5 . 铜(Ⅰ)配合物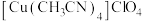 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。
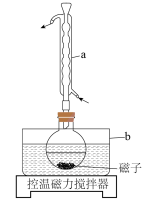
Ⅰ.制备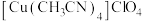
将乙腈 、
、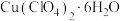 、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成 溶液。取
溶液。取 溶液,加入指示剂后,再用
溶液,加入指示剂后,再用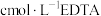 标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
已知:①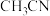 沸点为81℃,酸性条件下遇水生成
沸点为81℃,酸性条件下遇水生成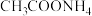 ;
;
②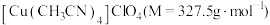 较易被空气氧化;
较易被空气氧化;
③EDTA与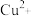 形成1:1配合物;
形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是___________ ;b中应加入___________ 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是___________ 。
(3)“一系列操作”依次为___________ 、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4) 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为___________ 。
(5)加入醋酸钠溶液的主要目的是___________ 。
(6)测得产品的纯度为___________ (用含m、c、V的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有___________。
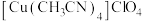 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。Ⅰ.制备
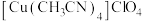
将乙腈
 、
、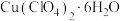 、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成
 溶液。取
溶液。取 溶液,加入指示剂后,再用
溶液,加入指示剂后,再用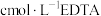 标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
已知:①
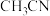 沸点为81℃,酸性条件下遇水生成
沸点为81℃,酸性条件下遇水生成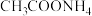 ;
;②
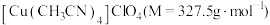 较易被空气氧化;
较易被空气氧化;③EDTA与
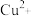 形成1:1配合物;
形成1:1配合物;④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是
(2)加入过量铜粉能提高产物的纯度,可能的原因是
(3)“一系列操作”依次为
(4)
 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为(5)加入醋酸钠溶液的主要目的是
(6)测得产品的纯度为
(7)下列情况会导致产品纯度测定结果偏高的有___________。
A.产品中含有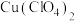 | B.滴定终点时俯视读数 |
| C.盛装EDTA溶液的滴定管未润洗 | D.产品干燥不充分 |
您最近一年使用:0次
2024-01-22更新
|
985次组卷
|
6卷引用:2024年1月广西普通高等学校招生考试适应性测试化学试题
2024年1月广西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”广西卷真题完全解读与考后提升(已下线)T17-实验综合题(已下线)T15-实验综合题辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题河北省石家庄市第二中学2023-2024学年高三下3月T8联考化学试题
23-24高三上·上海·阶段练习
名校
解题方法
6 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
(1)A装置中仪器a的名称为___________ 。装置D中NaOH溶液的作用是___________ 。
(2)装置A中生成ClO2的化学方程式为___________ 。
(3)仪器A中NaClO3需稍微过量,原因是___________ 。实验过程中,常需要打开K1,鼓入一定量空气,该操作的目的是___________ 。
(4)NaClO2纯度的测定:“间接碘量法”测定样品(杂质与I−不发生反应)纯度,过程如下:
取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO +4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
样品中NaClO2的纯度为___________ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)仪器A中NaClO3需稍微过量,原因是
(4)NaClO2纯度的测定:“间接碘量法”测定样品(杂质与I−不发生反应)纯度,过程如下:
取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
23-24高三上·重庆·阶段练习
名校
解题方法
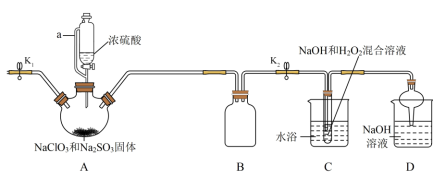
7 .  (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:① 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
② 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。
回答下列问题:
(1)甲装置中仪器A的名称是________ ,丙装置中多孔球泡装置的作用是_________ 。
(2)丁装置中发生反应的离子方程式为___________ 。
(3)实验室还可以直接使用 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的 晶体:
晶体:

在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
(5)产品纯度的测定:准确称取ag产品,配制成250mL溶液作为待测液,取25.00mL该溶液于碘量瓶中,加入稍过量的KI,用适量的盐酸酸化,盖紧塞子,置于避光处3min,用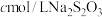 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: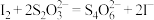 。
。
①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、___________ 。
②滴定达到终点的现象为___________ 。
③产品中 的质量分数为
的质量分数为___________ ( 的摩尔质量为
的摩尔质量为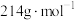 )。
)。
 (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:①
 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。②
 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。回答下列问题:
(1)甲装置中仪器A的名称是
(2)丁装置中发生反应的离子方程式为
(3)实验室还可以直接使用
 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的
 晶体:
晶体:
在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
| A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器 |
| B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净 |
| C.采用“抽滤”代替“过滤”可使过滤速率加快 |
| D.为提高洗涤效果,可用热水进行洗涤 |
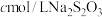 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: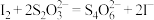 。
。①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、
②滴定达到终点的现象为
③产品中
 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为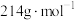 )。
)。
您最近一年使用:0次
23-24高三上·福建厦门·阶段练习
名校
解题方法
8 . 硼氢化钠(NaBH4)具有强还原剂,可溶于异丙胺或水,强碱环境下能稳定存在。实验室制备、提纯及分析NaBH4的实验过程如下。

(1)NaBH4的制备:先打开K2,向装置中鼓入N2,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭K2,打开K1通入H2,充分反应后制得NaH。然后升温到240℃,持续搅拌下通入N2,打开K3向三颈瓶中滴入B(OCH3)3(硼酸三甲酯,沸点68℃),充分反应后,降温后离心分离得到NaBH4和CH3ONa的固体混合物。
①NaH与B(OCH3)3反应的化学方程式为___________ 。
②下列说法正确的是___________ (填标号)。
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。
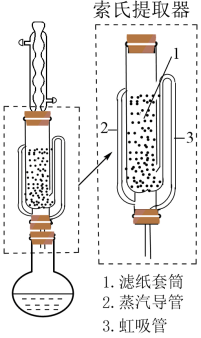
①实验时将NaBH4和CH3ONa的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(沸点33℃)受热蒸发,蒸汽沿导管___________ (填“2”或“3”)上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管___________ (填“2”或“3”)返回烧瓶,从而实现连续萃取。当萃取完全后,NaBH4在___________ (填“圆底烧瓶”或“索氏提取器”)中。
②分离异丙胺和NaBH4并回收溶剂的方法是___________ 。
(3) 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入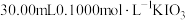 溶液充分反应
溶液充分反应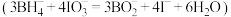 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗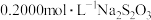 标准溶淮
标准溶淮 (发生反应
(发生反应 )。
)。
①根据所给试剂,判断 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为___________ 、___________ (填标号)。
A.稀硫酸
B. 溶液
溶液
C. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
D. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
②加入“溶液X2”后,发生的主要反应的离子方程式为___________ 。
③产品中 的纯度为
的纯度为___________  。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果___________ (填“偏高”或“偏低”)。

(1)NaBH4的制备:先打开K2,向装置中鼓入N2,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭K2,打开K1通入H2,充分反应后制得NaH。然后升温到240℃,持续搅拌下通入N2,打开K3向三颈瓶中滴入B(OCH3)3(硼酸三甲酯,沸点68℃),充分反应后,降温后离心分离得到NaBH4和CH3ONa的固体混合物。
①NaH与B(OCH3)3反应的化学方程式为
②下列说法正确的是
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。

①实验时将NaBH4和CH3ONa的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(沸点33℃)受热蒸发,蒸汽沿导管
②分离异丙胺和NaBH4并回收溶剂的方法是
(3)
 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入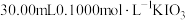 溶液充分反应
溶液充分反应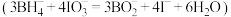 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗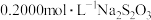 标准溶淮
标准溶淮 (发生反应
(发生反应 )。
)。①根据所给试剂,判断
 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为A.稀硫酸
B.
 溶液
溶液C.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)D.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)②加入“溶液X2”后,发生的主要反应的离子方程式为
③产品中
 的纯度为
的纯度为 。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果
您最近一年使用:0次
9 . 大苏打(Na2S2O3)是一种重要的化工产品,也是实验室常用试剂。某小组对大苏打展开如下探究。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:
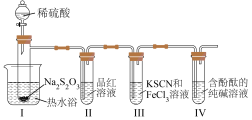
实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是_______ ,其他条件相同时,若拆去热水浴,试管Ⅱ中溶液褪色速率变_______ (填“快”或“慢”)。
(2)装置Ⅰ中的离子方程式为_______ 。
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为 的试剂是
的试剂是_______ 。由试管Ⅳ中现象可知,电离常数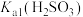
_______ (填“>”“<”或“=”) 。
。
实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
(4)
_______ 。
(5)实验记录: 。由实验①②得出的结论是
。由实验①②得出的结论是_______ 。设计实验①③的目的是_______ 。
实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示: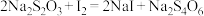 。
。
(6)Na2S2O3∙xH2O中x为_______ 。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:

实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是
(2)装置Ⅰ中的离子方程式为
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为
 的试剂是
的试剂是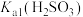
 。
。实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
| 编号 | 0.1mol∙L-1 Na2S2O3溶液的体积/mL | 0.1mol∙L-1 H2SO4溶液的体积/mL | 水的体积/mL | 水浴温度/℃ | 测定变浑浊时间/s |
| ① | 10.0 | 15.0 | 0 | 35 |  |
| ② | 10.0 | 10.0 |  | 35 |  |
| ③ |  | 15.0 | 0 | 45 | 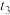 |
(4)
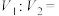
(5)实验记录:
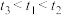 。由实验①②得出的结论是
。由实验①②得出的结论是实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示:
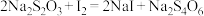 。
。(6)Na2S2O3∙xH2O中x为
您最近一年使用:0次
2023-12-15更新
|
191次组卷
|
5卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期11月份考试化学试卷
解题方法
10 . 利用草酸( )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。
实验流程:取血样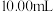 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙[
]溶液,析出草酸钙[ ]沉淀,将此沉淀洗涤后溶于强酸得草酸(
]沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的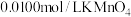 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液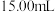 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。
(1) 标准溶液应用
标准溶液应用___________ (填“酸式”或“碱式”)滴定管盛装,注入 标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和
标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和___________ 。
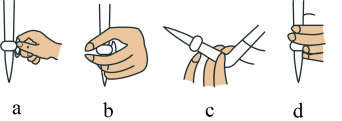
(2)①滴定前,装有 标准液的滴定管排气泡时,应选择下图中的
标准液的滴定管排气泡时,应选择下图中的_______ (填标号,下同)。
②若用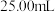 滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积_______ 。
A.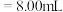 B.
B.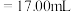 C.
C.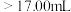 D.
D.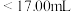
(3)请写出滴定过程中发生的离子反应方程式:___________ 。
(4)判断达到滴定终点的现象是___________ 。
(5)血液样品中 浓度为
浓度为___________  (保留2位有效数字)。
(保留2位有效数字)。
(6)判断下列操作对血液中钙离子的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①滴定前盛装酸性 标准溶液的滴定管未润洗,使测定结果
标准溶液的滴定管未润洗,使测定结果_______ 。
②滴定结束时俯视读数,使测定结果___________ 。
 )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。实验流程:取血样
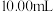 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙[
]溶液,析出草酸钙[ ]沉淀,将此沉淀洗涤后溶于强酸得草酸(
]沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的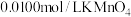 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液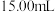 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。(1)
 标准溶液应用
标准溶液应用 标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和
标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和(2)①滴定前,装有
 标准液的滴定管排气泡时,应选择下图中的
标准液的滴定管排气泡时,应选择下图中的
②若用
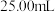 滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积A.
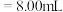 B.
B.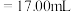 C.
C.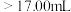 D.
D.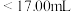
(3)请写出滴定过程中发生的离子反应方程式:
(4)判断达到滴定终点的现象是
(5)血液样品中
 浓度为
浓度为 (保留2位有效数字)。
(保留2位有效数字)。(6)判断下列操作对血液中钙离子的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①滴定前盛装酸性
 标准溶液的滴定管未润洗,使测定结果
标准溶液的滴定管未润洗,使测定结果②滴定结束时俯视读数,使测定结果
您最近一年使用:0次



