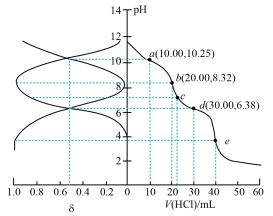
1 . 用0.1000mol·L-1盐酸滴定0.1000mol·L-1Na2A溶液20.00mL,溶液中H2A、HA-、 A2-的分布分数 δ随pH变化曲线及滴定曲线如图。下列说法不正确的是
[如A2-分布分数: δ(A2-)=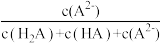
[如A2-分布分数: δ(A2-)=
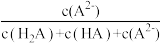

| A.a点溶液中存在c(Na+)+ c(H+)=3 c(A2-)+ c(OH-)+ c(Cl-) |
| B.b点溶液中存在c(H2A)< c(A2-) |
| C.c点溶液中存在c(HA-)>c(H2A) |
| D.H2A的Ka1为10-6.38 |
您最近一年使用:0次
名校
解题方法
2 . 常温下,用0.100mol⋅L 的NaOH溶液滴定20.00mL0.100mol•L
的NaOH溶液滴定20.00mL0.100mol•L 醋酸溶液,滴定曲线如图所示,下列说法正确的是
醋酸溶液,滴定曲线如图所示,下列说法正确的是
 的NaOH溶液滴定20.00mL0.100mol•L
的NaOH溶液滴定20.00mL0.100mol•L 醋酸溶液,滴定曲线如图所示,下列说法正确的是
醋酸溶液,滴定曲线如图所示,下列说法正确的是
A.a点溶液中,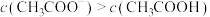 |
B.b点溶液中, |
C.c点溶液中, |
D.d点溶液中,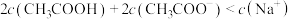 |
您最近一年使用:0次
2023-04-19更新
|
242次组卷
|
2卷引用:广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
名校
解题方法
3 . 室温下,向10.0mL纯碱(可能含有NaHCO3)的稀溶液中逐滴加入0.100mol•L-1盐酸,滴定曲线如图,其中p、q为滴定终点。

下列分析正确 的是

下列分析
A.m处溶液pH>7,原因是 +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
| B.由滴定数据可推知,原纯碱中不含NaHCO3 |
C.p和q处的溶液中,均存在c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
| D.原纯碱稀溶液中c(Na+)=0.215mol•L-1 |
您最近一年使用:0次
2023-04-01更新
|
1022次组卷
|
6卷引用:广西柳州高级中学2023-2024学年高三上学期8月开学考试化学试题
广西柳州高级中学2023-2024学年高三上学期8月开学考试化学试题北京市东城区2023届一模考试化学试题上海市青浦区2022-2023学年高三二模测试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题17 水溶液中的离子平衡(已下线)化学-2023年高考押题预测卷01(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)
名校
4 . 用0.1000mol/LNa2SO4标准溶液滴定20.00mLBaCl2溶液,测得溶液电导率σ及-lgc(Ba2+)随滴入Na2SO4标准溶液的体积V(Na2SO4)的变化关系如图所示。下列说法不正确的是
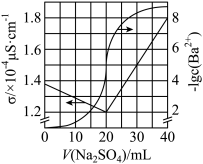
| A.BaCl2溶液的浓度为0.1000mol/L |
| B.Ksp(BaSO4)=10-10 |
| C.等浓度的Na+比Ba2+导电能力差 |
| D.若实验所用BaCl2溶液是用粗产品配制得来,则0.5000g粗产品中BaCl2•2H2O的质量分数为97.6% |
您最近一年使用:0次
2023-03-20更新
|
1919次组卷
|
7卷引用:化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷
5 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:_______ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是_______ 。
②装置B的作用是_______ 。
③A装置中,装H2SO4溶液的仪器名称为:_______ 。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______ 作指示剂,用0.1000mol·L ‑1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2 = 2I-+
= 2I-+ ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为_______ mol·L-1。
(4)下列操作使测定结果偏高的是_______
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③A装置中,装H2SO4溶液的仪器名称为:
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入
 = 2I-+
= 2I-+ ),当看到
),当看到(4)下列操作使测定结果偏高的是_______
| A.滴定前平视,滴定终点俯视读数 |
| B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗 |
| C.用C中溶液润洗锥形瓶,再取10mLC中溶液于锥形瓶中 |
| D.滴定前正常,滴定后滴定管尖嘴内有气泡 |
您最近一年使用:0次
6 . Ι.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)取 10.00mL 待测液,用_______ 量取。
(2)在滴定操作中,导致实验结果偏低的是_______ 。
①酸式滴定管用蒸馏水洗净后没有用标准液润洗
②指示剂变色时立即停止滴定
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
Ⅱ.氧化还原滴定法与酸碱中和滴定法类似,现用0.010mol/L酸性KMnO4溶液滴定未知浓度的H2C2O4溶液,反应的离子方程式为 。回答下列问题:
。回答下列问题:
(3)滴定时,KMnO4溶液应装在_______ (填“酸式”或“碱式”)滴定管中,该实验_______ (填“需要”或“不需要”)选用指示剂。滴定终点的判断_______ 。
(4)某次滴定前滴定管液面如图所示,读数为_______ mL

(1)取 10.00mL 待测液,用
(2)在滴定操作中,导致实验结果偏低的是
①酸式滴定管用蒸馏水洗净后没有用标准液润洗
②指示剂变色时立即停止滴定
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
Ⅱ.氧化还原滴定法与酸碱中和滴定法类似,现用0.010mol/L酸性KMnO4溶液滴定未知浓度的H2C2O4溶液,反应的离子方程式为
 。回答下列问题:
。回答下列问题:(3)滴定时,KMnO4溶液应装在
(4)某次滴定前滴定管液面如图所示,读数为

您最近一年使用:0次
名校
解题方法
7 . 硫氰化钾(KSCN) 俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
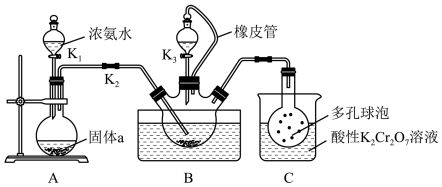
已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装浓氨水的仪器名称是___________ 。
(2)装置A用于制备NH3,圆底烧瓶内的固体a可以是___________ 。
(3)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+ 3NH3 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热三颈烧瓶,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热三颈烧瓶,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是___________ 。一段时间后,当观察到三颈烧瓶内液体不再分层时,停止通入气体,反应完成。
II.制备KSCN溶液
(4)关闭K1,加热三颈烧瓶,保持水浴温度为100℃一段时间,使分解反应(NH4HS=NH3↑+H2S↑)进行完全后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。装置C中酸性K2Cr2O7溶液除能将H2S气体氧化成硫酸外,还可以___________ 。
III.制备KSCN晶体
(5)先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有___________ (填标号)。
A.坩埚 B.蒸发皿 C.分液漏斗 D.玻璃棒 E.烧杯
(6)测定晶体中KSCN的含量:称取3.0g样品,配成250mL溶液。量取25. 00mL溶液加入锥形瓶中,加入适量稀硝酸,再加入几滴Fe (NO3) 3溶液作指示剂,用0. 1000mol/L AgNO3标准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液24.00mL。[已知: SCN-+Ag+=AgSCN↓(白色) ]
①晶体中KSCN的质量分数为___________ (计算结果保留三位有效数字)。
②滴定达到终点后,发现滴定管尖嘴处悬挂有一滴AgNO3标准溶液,则测得KSCN的质量分数___________ (填“偏大”、“偏小”或“无影响”)。

已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装浓氨水的仪器名称是
(2)装置A用于制备NH3,圆底烧瓶内的固体a可以是
(3)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+ 3NH3
 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热三颈烧瓶,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热三颈烧瓶,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是II.制备KSCN溶液
(4)关闭K1,加热三颈烧瓶,保持水浴温度为100℃一段时间,使分解反应(NH4HS=NH3↑+H2S↑)进行完全后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。装置C中酸性K2Cr2O7溶液除能将H2S气体氧化成硫酸外,还可以
III.制备KSCN晶体
(5)先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有
A.坩埚 B.蒸发皿 C.分液漏斗 D.玻璃棒 E.烧杯
(6)测定晶体中KSCN的含量:称取3.0g样品,配成250mL溶液。量取25. 00mL溶液加入锥形瓶中,加入适量稀硝酸,再加入几滴Fe (NO3) 3溶液作指示剂,用0. 1000mol/L AgNO3标准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液24.00mL。[已知: SCN-+Ag+=AgSCN↓(白色) ]
①晶体中KSCN的质量分数为
②滴定达到终点后,发现滴定管尖嘴处悬挂有一滴AgNO3标准溶液,则测得KSCN的质量分数
您最近一年使用:0次
2022-10-01更新
|
190次组卷
|
2卷引用:广西玉林市普通高中2021-2022学年高二下学期期末考试理科综合化学试题
名校
8 . 下列关于酸碱中和滴定的叙述中,正确的是
| A.进行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗 |
| B.滴定前应排除尖嘴部分的气泡 |
| C.滴定结束时仰视标准液读数会使测定结果偏小 |
| D.锥形瓶内溶液颜色突变说明到达滴定终点 |
您最近一年使用:0次
2022-09-13更新
|
411次组卷
|
3卷引用:广西壮族自治区梧州市苍梧中学2022-2023学年高二上学期11月月考化学试题
名校
解题方法
9 . 三氯化六氨合钴( )是一种橙黄色晶体,实验室制备过程如下:
)是一种橙黄色晶体,实验室制备过程如下:
Ⅰ.将研细的 晶体和
晶体和 固体加入锥形瓶中,加水,加热溶解,冷却;
固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5mL5% 溶液,水浴加热至50~60℃,保持20min。用冰浴冷却,过滤,得粗产品;
溶液,水浴加热至50~60℃,保持20min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50mL热的稀盐酸中,___________,向滤液中缓慢加入6.7mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的 溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1) 中Co的化合价是
中Co的化合价是___________ ,中心离子的核外电子排布式为___________ ,不考虑空间构型,配合物离子的结构可用示意图表示为___________ 。
(2) 遇浓氨水生成
遇浓氨水生成 沉淀,加入浓氨水前先加入
沉淀,加入浓氨水前先加入 可避免沉淀生成,原因是
可避免沉淀生成,原因是___________ 。
(3)溶液中 、
、 和浓氨水混合后,与
和浓氨水混合后,与 溶液反应生成
溶液反应生成 的化学方程式是
的化学方程式是___________ 。
(4)Ⅲ中的操作是___________ (填“趁热过滤”或“冷却过滤”),加入浓盐酸的作用是___________ 。
(5)沉淀滴定法测定制备的产品中 的质量分数:
的质量分数:
ⅰ.准确称取agⅣ中的产品,配制成100mL溶液,移取25mL溶液于锥形瓶中;
ⅱ.滴加少量 溶液作为指示剂,用
溶液作为指示剂,用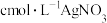 溶液滴定至终点;
溶液滴定至终点;
ⅲ.平行测定三次,消耗 溶液的体积的平均值为vmL,计算晶体中
溶液的体积的平均值为vmL,计算晶体中 的质量分数。
的质量分数。
已知:溶解度:
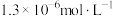 ,
, (砖红色)
(砖红色)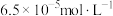
①ⅱ中,滴定至终点的现象是___________ 。
②制备的晶体中 的质量分数是
的质量分数是_____ (列计算式,相对原子质量:Cl 35.5)。
 )是一种橙黄色晶体,实验室制备过程如下:
)是一种橙黄色晶体,实验室制备过程如下:Ⅰ.将研细的
 晶体和
晶体和 固体加入锥形瓶中,加水,加热溶解,冷却;
固体加入锥形瓶中,加水,加热溶解,冷却;Ⅱ.加入13.5mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5mL5%
 溶液,水浴加热至50~60℃,保持20min。用冰浴冷却,过滤,得粗产品;
溶液,水浴加热至50~60℃,保持20min。用冰浴冷却,过滤,得粗产品;Ⅲ.将粗产品溶于50mL热的稀盐酸中,___________,向滤液中缓慢加入6.7mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的
 溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。(1)
 中Co的化合价是
中Co的化合价是(2)
 遇浓氨水生成
遇浓氨水生成 沉淀,加入浓氨水前先加入
沉淀,加入浓氨水前先加入 可避免沉淀生成,原因是
可避免沉淀生成,原因是(3)溶液中
 、
、 和浓氨水混合后,与
和浓氨水混合后,与 溶液反应生成
溶液反应生成 的化学方程式是
的化学方程式是(4)Ⅲ中的操作是
(5)沉淀滴定法测定制备的产品中
 的质量分数:
的质量分数:ⅰ.准确称取agⅣ中的产品,配制成100mL溶液,移取25mL溶液于锥形瓶中;
ⅱ.滴加少量
 溶液作为指示剂,用
溶液作为指示剂,用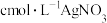 溶液滴定至终点;
溶液滴定至终点;ⅲ.平行测定三次,消耗
 溶液的体积的平均值为vmL,计算晶体中
溶液的体积的平均值为vmL,计算晶体中 的质量分数。
的质量分数。已知:溶解度:

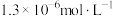 ,
, (砖红色)
(砖红色)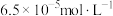
①ⅱ中,滴定至终点的现象是
②制备的晶体中
 的质量分数是
的质量分数是
您最近一年使用:0次
2022-08-25更新
|
371次组卷
|
2卷引用:广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题
解题方法
10 . I.化学实验是中学化学学习中必不可少的一环。根据要求,回答下列问题:
(1)在测定中和反应的反应热时,如图所示:

①仪器a的名称为_______ 。
②某同学每次分别取0.50mol·L-150mLNaOH溶液和0.50mol·L-130mL硫酸进行实验,通过多次实验测定中和热的测量值为53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(2)在进行酸碱中和滴定实验时:
①滴定管的使用。在使用滴定管前,要_______ 。
②用0.1000mol·L-1HCl溶液滴定未知浓度的NaOH溶液,用酚酞溶液作指示剂,达到滴定终点时的现象是_______ 。
II.常温下,有关4种溶液的信息如下:
已知:NH3·H2O与CH3COOH的电离常数都约为1. 8×10-5。
请回答下列问题:
(3)取等体积的溶液①与④混合后,所得溶液呈_______ 性(填“酸”“中”或“碱”)。
(4)将aL溶液②与bL溶液④混合后,若所得溶液的pH=4(忽略溶液混合的体积变化),则a:b=_______ 。
(5)将等体积的pH=3的溶液③与④加水分别稀释1 000倍后,所得溶液的pH____ 大(填序号)。
(6)将溶液②与溶液③等体积混合后,所得溶液中离子及浓度如图所示:

图中X表示_______ 。
(1)在测定中和反应的反应热时,如图所示:

①仪器a的名称为
②某同学每次分别取0.50mol·L-150mLNaOH溶液和0.50mol·L-130mL硫酸进行实验,通过多次实验测定中和热的测量值为53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(2)在进行酸碱中和滴定实验时:
①滴定管的使用。在使用滴定管前,要
②用0.1000mol·L-1HCl溶液滴定未知浓度的NaOH溶液,用酚酞溶液作指示剂,达到滴定终点时的现象是
II.常温下,有关4种溶液的信息如下:
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
已知:NH3·H2O与CH3COOH的电离常数都约为1. 8×10-5。
请回答下列问题:
(3)取等体积的溶液①与④混合后,所得溶液呈
(4)将aL溶液②与bL溶液④混合后,若所得溶液的pH=4(忽略溶液混合的体积变化),则a:b=
(5)将等体积的pH=3的溶液③与④加水分别稀释1 000倍后,所得溶液的pH
(6)将溶液②与溶液③等体积混合后,所得溶液中离子及浓度如图所示:

图中X表示
您最近一年使用:0次



