名校
解题方法
1 .  (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
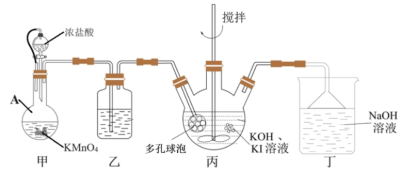
已知:① 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
② 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。
回答下列问题:
(1)甲装置中仪器A的名称是________ ,丙装置中多孔球泡装置的作用是_________ 。
(2)丁装置中发生反应的离子方程式为___________ 。
(3)实验室还可以直接使用 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的 晶体:
晶体:

在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
(5)产品纯度的测定:准确称取ag产品,配制成250mL溶液作为待测液,取25.00mL该溶液于碘量瓶中,加入稍过量的KI,用适量的盐酸酸化,盖紧塞子,置于避光处3min,用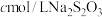 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: 。
。
①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、___________ 。
②滴定达到终点的现象为___________ 。
③产品中 的质量分数为
的质量分数为___________ ( 的摩尔质量为
的摩尔质量为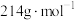 )。
)。
 (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:①
 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。②
 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。回答下列问题:
(1)甲装置中仪器A的名称是
(2)丁装置中发生反应的离子方程式为
(3)实验室还可以直接使用
 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的
 晶体:
晶体:
在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
| A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器 |
| B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净 |
| C.采用“抽滤”代替“过滤”可使过滤速率加快 |
| D.为提高洗涤效果,可用热水进行洗涤 |
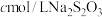 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: 。
。①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、
②滴定达到终点的现象为
③产品中
 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为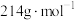 )。
)。
您最近一年使用:0次
名校
解题方法
2 . 硼氢化钠(NaBH4)具有强还原剂,可溶于异丙胺或水,强碱环境下能稳定存在。实验室制备、提纯及分析NaBH4的实验过程如下。
①NaH与B(OCH3)3反应的化学方程式为___________ 。
②下列说法正确的是___________ (填标号)。
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。___________ (填“2”或“3”)上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管___________ (填“2”或“3”)返回烧瓶,从而实现连续萃取。当萃取完全后,NaBH4在___________ (填“圆底烧瓶”或“索氏提取器”)中。
②分离异丙胺和NaBH4并回收溶剂的方法是___________ 。
(3) 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入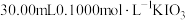 溶液充分反应
溶液充分反应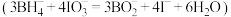 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗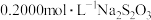 标准溶液
标准溶液 (发生反应
(发生反应 )。
)。
①根据所给试剂,判断 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为___________ 、___________ (填标号)。
A.稀硫酸
B. 溶液
溶液
C. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
D. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
②加入“溶液X2”后,发生的主要反应的离子方程式为___________ 。
③产品中 的纯度为
的纯度为___________  。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果___________ (填“偏高”或“偏低”)。

①NaH与B(OCH3)3反应的化学方程式为
②下列说法正确的是
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。
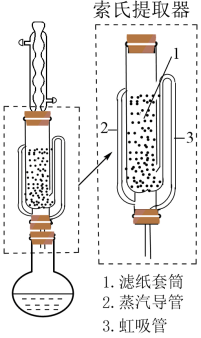
②分离异丙胺和NaBH4并回收溶剂的方法是
(3)
 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入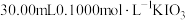 溶液充分反应
溶液充分反应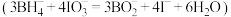 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗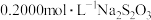 标准溶液
标准溶液 (发生反应
(发生反应 )。
)。①根据所给试剂,判断
 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为A.稀硫酸
B.
 溶液
溶液C.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)D.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)②加入“溶液X2”后,发生的主要反应的离子方程式为
③产品中
 的纯度为
的纯度为 。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果
您最近一年使用:0次
3 . 大苏打(Na2S2O3)是一种重要的化工产品,也是实验室常用试剂。某小组对大苏打展开如下探究。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:
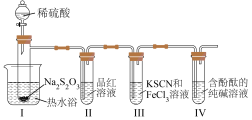
实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是_______ ,其他条件相同时,若拆去热水浴,试管Ⅱ中溶液褪色速率变_______ (填“快”或“慢”)。
(2)装置Ⅰ中的离子方程式为_______ 。
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为 的试剂是
的试剂是_______ 。由试管Ⅳ中现象可知,电离常数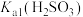
_______ (填“>”“<”或“=”) 。
。
实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
(4)
_______ 。
(5)实验记录: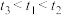 。由实验①②得出的结论是
。由实验①②得出的结论是_______ 。设计实验①③的目的是_______ 。
实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示: 。
。
(6)Na2S2O3∙xH2O中x为_______ 。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:

实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是
(2)装置Ⅰ中的离子方程式为
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为
 的试剂是
的试剂是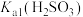
 。
。实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
| 编号 | 0.1mol∙L-1 Na2S2O3溶液的体积/mL | 0.1mol∙L-1 H2SO4溶液的体积/mL | 水的体积/mL | 水浴温度/℃ | 测定变浑浊时间/s |
| ① | 10.0 | 15.0 | 0 | 35 |  |
| ② | 10.0 | 10.0 |  | 35 |  |
| ③ |  | 15.0 | 0 | 45 |  |
(4)

(5)实验记录:
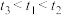 。由实验①②得出的结论是
。由实验①②得出的结论是实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示:
 。
。(6)Na2S2O3∙xH2O中x为
您最近一年使用:0次
2023-12-15更新
|
198次组卷
|
5卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期11月份考试化学试卷
解题方法
4 . 利用草酸( )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。
实验流程:取血样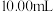 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙[
]溶液,析出草酸钙[ ]沉淀,将此沉淀洗涤后溶于强酸得草酸(
]沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的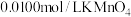 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液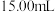 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。
(1) 标准溶液应用
标准溶液应用___________ (填“酸式”或“碱式”)滴定管盛装,注入 标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和
标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和___________ 。
(2)①滴定前,装有 标准液的滴定管排气泡时,应选择下图中的
标准液的滴定管排气泡时,应选择下图中的_______ (填标号,下同)。
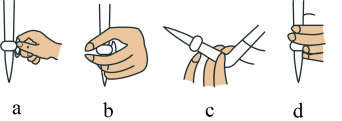
②若用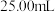 滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积_______ 。
A.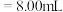 B.
B.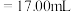 C.
C.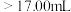 D.
D.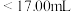
(3)请写出滴定过程中发生的离子反应方程式:___________ 。
(4)判断达到滴定终点的现象是___________ 。
(5)血液样品中 浓度为
浓度为___________  (保留2位有效数字)。
(保留2位有效数字)。
(6)判断下列操作对血液中钙离子的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①滴定前盛装酸性 标准溶液的滴定管未润洗,使测定结果
标准溶液的滴定管未润洗,使测定结果_______ 。
②滴定结束时俯视读数,使测定结果___________ 。
 )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。实验流程:取血样
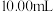 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙[
]溶液,析出草酸钙[ ]沉淀,将此沉淀洗涤后溶于强酸得草酸(
]沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的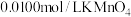 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液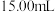 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。(1)
 标准溶液应用
标准溶液应用 标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和
标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和(2)①滴定前,装有
 标准液的滴定管排气泡时,应选择下图中的
标准液的滴定管排气泡时,应选择下图中的
②若用
 滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积A.
 B.
B. C.
C.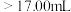 D.
D.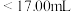
(3)请写出滴定过程中发生的离子反应方程式:
(4)判断达到滴定终点的现象是
(5)血液样品中
 浓度为
浓度为 (保留2位有效数字)。
(保留2位有效数字)。(6)判断下列操作对血液中钙离子的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①滴定前盛装酸性
 标准溶液的滴定管未润洗,使测定结果
标准溶液的滴定管未润洗,使测定结果②滴定结束时俯视读数,使测定结果
您最近一年使用:0次
5 . 氯化钛(TiCl3)是制取海绵钛和钛白粉的重要原料,常温下其为深紫色晶体,熔点为440℃,易吸水潮解,常用作还原剂。实验室根据反应2TiCl4+H2 2TiCl3+2HCl,利用如图装置制备TiCl3(加热及夹持装置略)。
2TiCl3+2HCl,利用如图装置制备TiCl3(加热及夹持装置略)。
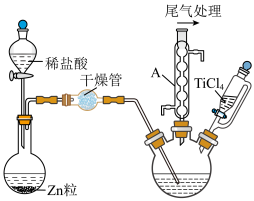
回答下列问题:
(1)仪器A的名称为________ 。
(2)制备TiCl3时进行的操作:
(Ⅰ)检查装置气密性,并添加试剂;
(Ⅱ)打开分液漏斗的活塞;
(Ⅲ)……
(Ⅳ)打开恒压滴液漏斗加入TiCl4,加热至1000℃,反应一段时间;
(V)停止加热,冷却后关闭分液漏斗的活塞。
干燥管中试剂为_________ ;操作(Ⅲ)为________ 。图示装置存在的一处缺陷是_______ 。
(3)产品纯度测定:
①称取m1g产品溶于水配成250mL溶液(Ti元素的存在形式为Ti3+),取V1mL待测液,加入指示剂KSCN溶液,用nmol•L-1FeCl3标准液滴定至终点,消耗标准液V2mL。产品的纯度为_________ (用含m1、n、V1、V2的代数式表示)。
②滴定终点时溶液颜色变化为________ 。
③下列情况会导致产品纯度测量值偏大的是_______ (填标号)。
A.配制待测液时未除去水中溶解的氧气
B.取待测液时滴定管未润洗
C.用滴定管取标准液,滴定前滴定管尖嘴内有气泡,滴定后无气泡
 2TiCl3+2HCl,利用如图装置制备TiCl3(加热及夹持装置略)。
2TiCl3+2HCl,利用如图装置制备TiCl3(加热及夹持装置略)。
回答下列问题:
(1)仪器A的名称为
(2)制备TiCl3时进行的操作:
(Ⅰ)检查装置气密性,并添加试剂;
(Ⅱ)打开分液漏斗的活塞;
(Ⅲ)……
(Ⅳ)打开恒压滴液漏斗加入TiCl4,加热至1000℃,反应一段时间;
(V)停止加热,冷却后关闭分液漏斗的活塞。
干燥管中试剂为
(3)产品纯度测定:
①称取m1g产品溶于水配成250mL溶液(Ti元素的存在形式为Ti3+),取V1mL待测液,加入指示剂KSCN溶液,用nmol•L-1FeCl3标准液滴定至终点,消耗标准液V2mL。产品的纯度为
②滴定终点时溶液颜色变化为
③下列情况会导致产品纯度测量值偏大的是
A.配制待测液时未除去水中溶解的氧气
B.取待测液时滴定管未润洗
C.用滴定管取标准液,滴定前滴定管尖嘴内有气泡,滴定后无气泡
您最近一年使用:0次
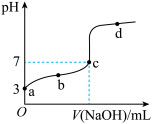
6 . 常温下向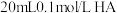 溶液中逐滴加入
溶液中逐滴加入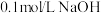 溶液,其
溶液,其 变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
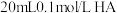 溶液中逐滴加入
溶液中逐滴加入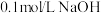 溶液,其
溶液,其 变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
A.由题可知 为弱酸 为弱酸 |
| B.c点时,酸过量 |
C.滴定到b点时, |
D.滴定到d点时,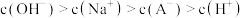 |
您最近一年使用:0次
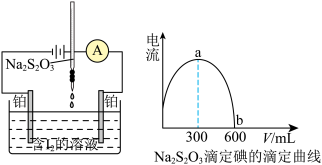
7 . 电流滴定法(电压10~100mV)是根据电流情况判断滴定终点,如图所示,仅 、
、 同时存在时才能产生电流。可用此法来测定
同时存在时才能产生电流。可用此法来测定 溶液的浓度。已知:
溶液的浓度。已知: 。下列说法错误的是
。下列说法错误的是
 、
、 同时存在时才能产生电流。可用此法来测定
同时存在时才能产生电流。可用此法来测定 溶液的浓度。已知:
溶液的浓度。已知: 。下列说法错误的是
。下列说法错误的是
| A.b为滴定终点 |
| B.ab段电流减小是因为离子浓度降低 |
| C.该反应可不用指示剂,电流就可以判断滴定情况 |
D.若碘液中含有38.1 g的 ,硫代硫酸钠溶液的浓度为0.5 mol⋅L ,硫代硫酸钠溶液的浓度为0.5 mol⋅L |
您最近一年使用:0次
名校
解题方法
8 . 草酸亚铁晶体(FeC2O4•2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。南宁三中实验小组对其进行了一系列探究。采用如图装置进行实验。
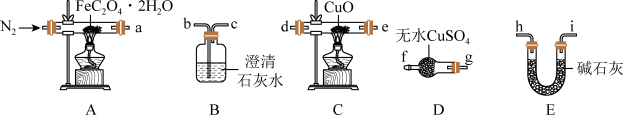
(1)为验证FeC2O4•2H2O的分解的气态产物,按照气流从左到右的方向,上述装置的连接顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(4)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol/LKMnO4标准溶液滴定至终点,消耗标准液V2mL。
①步骤2中滴定终点的现象为_______ ;步骤3加入锌粉的目的_______ 。
②该样品中草酸亚铁晶体的质量分数的计算式为_______ 。
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。

(1)为验证FeC2O4•2H2O的分解的气态产物,按照气流从左到右的方向,上述装置的连接顺序为A→
(2)实验证明了气体产物中含有CO,依据的实验现象为
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(4)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol/LKMnO4标准溶液滴定至终点,消耗标准液V2mL。
①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的计算式为
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
名校
解题方法
9 . 下列图示与对应的叙述相符的是
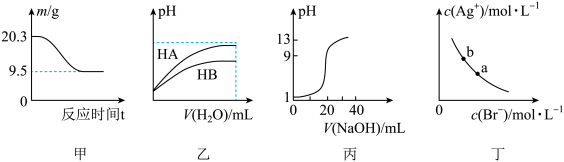

| A.图甲表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化 |
| B.图乙表示常温下,稀释等体积、等pH的HA、HB两种弱酸的稀溶液时溶液pH随加水量的变化,则:Ka(HA)<Ka(HB) |
| C.图丙表示0.1mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1醋酸溶液得到的滴定曲线 |
| D.图丁表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,则加入AgNO3固体,a点向b点迁移 |
您最近一年使用:0次
名校
10 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
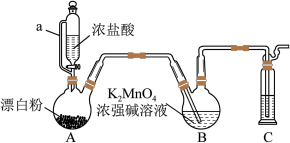
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO +2H2O═2MnO
+2H2O═2MnO +MnO2↓+4OH-
+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是_________ 装置C中的试剂为_________ ;装置A中制备Cl2的化学方程式为_________ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是_________ 。
(3)高锰酸钾还可以用电解法制备:
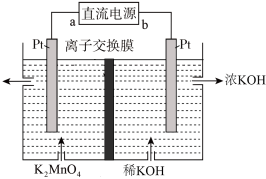
①电解时阳极的电极反应式是_________ 。
②该装置中的离子交换膜是_________ 离子交换膜(填“阴”或“阳”)。
(4)某化学学习小组测定某草酸溶液的浓度,并用所测草酸溶液测定某样品中高锰酸钾的纯度(已知:杂质不参与反应;KMnO4的摩尔质量为158g/mol),进行了如下实验:
步骤i.配制0.1000mol/L的标准氢氧化钠溶液;
步骤ii.取草酸溶液10.00mL,用0.1000mol/L的标准氢氧化钠溶液滴定,结果用去氢氧化钠溶液20.00mL;
步骤iii.取1.0g样品溶于水,滴入几滴稀硫酸酸化,用测定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液50.00mL。
①步骤ii中应选择_________ 作指示剂。
②样品中高锰酸钾的纯度为_________ 。
③本实验中,若第一次滴定时盛装氢氧化钠溶液的滴定管未润洗,会测得高锰酸钾纯度_________ (填“偏大”、“偏小”或“无影响”)。

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO
 +2H2O═2MnO
+2H2O═2MnO +MnO2↓+4OH-
+MnO2↓+4OH-回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是
(3)高锰酸钾还可以用电解法制备:

①电解时阳极的电极反应式是
②该装置中的离子交换膜是
(4)某化学学习小组测定某草酸溶液的浓度,并用所测草酸溶液测定某样品中高锰酸钾的纯度(已知:杂质不参与反应;KMnO4的摩尔质量为158g/mol),进行了如下实验:
步骤i.配制0.1000mol/L的标准氢氧化钠溶液;
步骤ii.取草酸溶液10.00mL,用0.1000mol/L的标准氢氧化钠溶液滴定,结果用去氢氧化钠溶液20.00mL;
步骤iii.取1.0g样品溶于水,滴入几滴稀硫酸酸化,用测定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液50.00mL。
①步骤ii中应选择
②样品中高锰酸钾的纯度为
③本实验中,若第一次滴定时盛装氢氧化钠溶液的滴定管未润洗,会测得高锰酸钾纯度
您最近一年使用:0次



