名校
1 . 铜(Ⅰ)配合物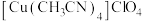 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。
Ⅰ.制备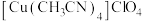
将乙腈 、
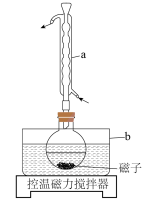
、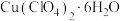 、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成 溶液。取
溶液。取 溶液,加入指示剂后,再用
溶液,加入指示剂后,再用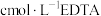 标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
已知:① 沸点为81℃,酸性条件下遇水生成
沸点为81℃,酸性条件下遇水生成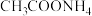 ;
;
②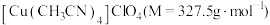 较易被空气氧化;
较易被空气氧化;
③EDTA与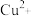 形成1:1配合物;
形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是___________ ;b中应加入___________ 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是___________ 。
(3)“一系列操作”依次为___________ 、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4) 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为___________ 。
(5)加入醋酸钠溶液的主要目的是___________ 。
(6)测得产品的纯度为___________ (用含m、c、V的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有___________。
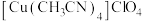 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。Ⅰ.制备
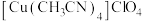
将乙腈
 、
、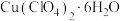 、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成
 溶液。取
溶液。取 溶液,加入指示剂后,再用
溶液,加入指示剂后,再用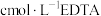 标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
已知:①
 沸点为81℃,酸性条件下遇水生成
沸点为81℃,酸性条件下遇水生成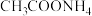 ;
;②
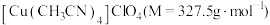 较易被空气氧化;
较易被空气氧化;③EDTA与
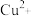 形成1:1配合物;
形成1:1配合物;④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是
(2)加入过量铜粉能提高产物的纯度,可能的原因是
(3)“一系列操作”依次为
(4)
 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为(5)加入醋酸钠溶液的主要目的是
(6)测得产品的纯度为
(7)下列情况会导致产品纯度测定结果偏高的有___________。
A.产品中含有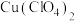 | B.滴定终点时俯视读数 |
| C.盛装EDTA溶液的滴定管未润洗 | D.产品干燥不充分 |
您最近一年使用:0次
2024-01-22更新
|
987次组卷
|
6卷引用:2024年1月广西普通高等学校招生考试适应性测试化学试题
2024年1月广西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”广西卷真题完全解读与考后提升(已下线)T17-实验综合题(已下线)T15-实验综合题辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题河北省石家庄市第二中学2023-2024学年高三下3月T8联考化学试题
名校
解题方法
2 . 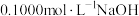 溶液滴定
溶液滴定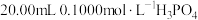 溶液时,
溶液时,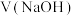 、各含磷元素微粒的
、各含磷元素微粒的 和
和 的关系如图。下列说法中正确的是
的关系如图。下列说法中正确的是
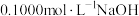 溶液滴定
溶液滴定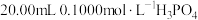 溶液时,
溶液时,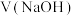 、各含磷元素微粒的
、各含磷元素微粒的 和
和 的关系如图。下列说法中正确的是
的关系如图。下列说法中正确的是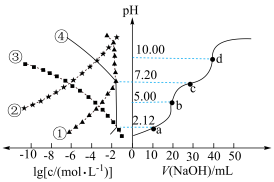
A.①为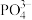 的 的 与 与 的关系 的关系 |
B.b点时,溶液中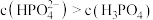 |
C. 的 的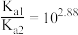 |
D.d点时,溶液中存在着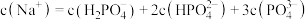 |
您最近一年使用:0次
2024-01-22更新
|
1895次组卷
|
12卷引用:2024年1月广西普通高等学校招生考试适应性测试化学试题
2024年1月广西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”广西卷真题完全解读与考后提升(已下线)选择题11-14(已下线)热点18 电解质溶液图像分析重庆市第七中学校2023-2024学年高三下学期2月月考化学试题辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题山东省济宁市第一中学2023-2024学年高三下学期3月月考化学试题湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题
23-24高三上·上海·阶段练习
名校
解题方法
3 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
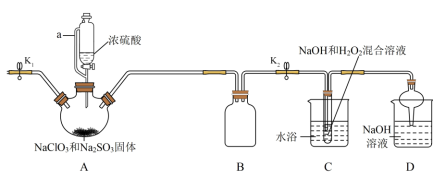
(1)A装置中仪器a的名称为___________ 。装置D中NaOH溶液的作用是___________ 。
(2)装置A中生成ClO2的化学方程式为___________ 。
(3)仪器A中NaClO3需稍微过量,原因是___________ 。实验过程中,常需要打开K1,鼓入一定量空气,该操作的目的是___________ 。
(4)NaClO2纯度的测定:“间接碘量法”测定样品(杂质与I−不发生反应)纯度,过程如下:
取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO +4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
样品中NaClO2的纯度为___________ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)仪器A中NaClO3需稍微过量,原因是
(4)NaClO2纯度的测定:“间接碘量法”测定样品(杂质与I−不发生反应)纯度,过程如下:
取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
23-24高三上·辽宁·期末
解题方法
4 . 实验室以活性炭为催化剂,用CoCl2制取三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3},装置如图所示。
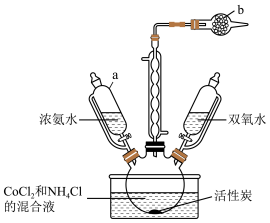
已知:[Co(NH3)6]2+具有较强还原性,溶液呈棕色。
回答下列问题:
(1)仪器b的名称是___________ ,其作用是___________ 。
(2)产品制备。检查装置气密性并将CoCl2、NH4Cl和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色;充分反应后缓慢滴加双氧水,水浴加热20min。水浴加热温度不宜过高的原因是___________ ,滴加双氧水后发生反应的化学方程式为___________ 。
(3)产品分离提纯。将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到[Co(NH3)6]Cl3晶体。该过程中加入浓盐酸的目的是___________ 。
(4)测定产品纯度。实验如下:
①蒸氨:取10.0g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的NH3通入含有V1mLc1mol/LH2SO4标准溶液的锥形瓶中。
②滴定:用c2rmol/LNaOH溶液滴定剩余的H2SO4,消耗V2mLNaOH溶液,则产品纯度为___________ %(用含c1、c2、V1、V2的代数式表示);达到滴定终点读数时若仰视滴定管刻度线,则产品纯度___________ (填“偏高”、“偏低”或“无影响”)。

已知:[Co(NH3)6]2+具有较强还原性,溶液呈棕色。
回答下列问题:
(1)仪器b的名称是
(2)产品制备。检查装置气密性并将CoCl2、NH4Cl和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色;充分反应后缓慢滴加双氧水,水浴加热20min。水浴加热温度不宜过高的原因是
(3)产品分离提纯。将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到[Co(NH3)6]Cl3晶体。该过程中加入浓盐酸的目的是
(4)测定产品纯度。实验如下:
①蒸氨:取10.0g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的NH3通入含有V1mLc1mol/LH2SO4标准溶液的锥形瓶中。
②滴定:用c2rmol/LNaOH溶液滴定剩余的H2SO4,消耗V2mLNaOH溶液,则产品纯度为
您最近一年使用:0次
23-24高三上·重庆·阶段练习
名校
解题方法
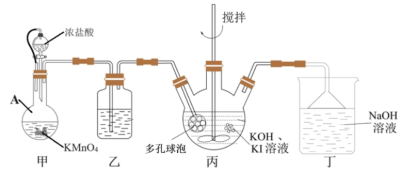
5 .  (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:① 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
② 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。
回答下列问题:
(1)甲装置中仪器A的名称是________ ,丙装置中多孔球泡装置的作用是_________ 。
(2)丁装置中发生反应的离子方程式为___________ 。
(3)实验室还可以直接使用 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的 晶体:
晶体:

在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
(5)产品纯度的测定:准确称取ag产品,配制成250mL溶液作为待测液,取25.00mL该溶液于碘量瓶中,加入稍过量的KI,用适量的盐酸酸化,盖紧塞子,置于避光处3min,用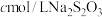 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: 。
。
①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、___________ 。
②滴定达到终点的现象为___________ 。
③产品中 的质量分数为
的质量分数为___________ ( 的摩尔质量为
的摩尔质量为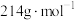 )。
)。
 (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:①
 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。②
 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。回答下列问题:
(1)甲装置中仪器A的名称是
(2)丁装置中发生反应的离子方程式为
(3)实验室还可以直接使用
 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的
 晶体:
晶体:
在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
| A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器 |
| B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净 |
| C.采用“抽滤”代替“过滤”可使过滤速率加快 |
| D.为提高洗涤效果,可用热水进行洗涤 |
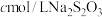 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: 。
。①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、
②滴定达到终点的现象为
③产品中
 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为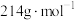 )。
)。
您最近一年使用:0次
23-24高三上·福建厦门·阶段练习
名校
解题方法
6 . 硼氢化钠(NaBH4)具有强还原剂,可溶于异丙胺或水,强碱环境下能稳定存在。实验室制备、提纯及分析NaBH4的实验过程如下。

(1)NaBH4的制备:先打开K2,向装置中鼓入N2,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭K2,打开K1通入H2,充分反应后制得NaH。然后升温到240℃,持续搅拌下通入N2,打开K3向三颈瓶中滴入B(OCH3)3(硼酸三甲酯,沸点68℃),充分反应后,降温后离心分离得到NaBH4和CH3ONa的固体混合物。
①NaH与B(OCH3)3反应的化学方程式为___________ 。
②下列说法正确的是___________ (填标号)。
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。
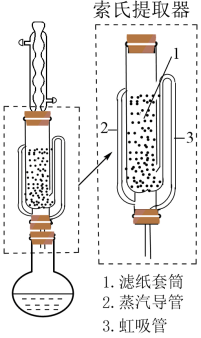
①实验时将NaBH4和CH3ONa的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(沸点33℃)受热蒸发,蒸汽沿导管___________ (填“2”或“3”)上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管___________ (填“2”或“3”)返回烧瓶,从而实现连续萃取。当萃取完全后,NaBH4在___________ (填“圆底烧瓶”或“索氏提取器”)中。
②分离异丙胺和NaBH4并回收溶剂的方法是___________ 。
(3) 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入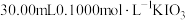 溶液充分反应
溶液充分反应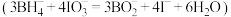 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗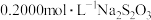 标准溶淮
标准溶淮 (发生反应
(发生反应 )。
)。
①根据所给试剂,判断 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为___________ 、___________ (填标号)。
A.稀硫酸
B. 溶液
溶液
C. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
D. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
②加入“溶液X2”后,发生的主要反应的离子方程式为___________ 。
③产品中 的纯度为
的纯度为___________  。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果___________ (填“偏高”或“偏低”)。

(1)NaBH4的制备:先打开K2,向装置中鼓入N2,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭K2,打开K1通入H2,充分反应后制得NaH。然后升温到240℃,持续搅拌下通入N2,打开K3向三颈瓶中滴入B(OCH3)3(硼酸三甲酯,沸点68℃),充分反应后,降温后离心分离得到NaBH4和CH3ONa的固体混合物。
①NaH与B(OCH3)3反应的化学方程式为
②下列说法正确的是
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。

①实验时将NaBH4和CH3ONa的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(沸点33℃)受热蒸发,蒸汽沿导管
②分离异丙胺和NaBH4并回收溶剂的方法是
(3)
 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入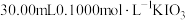 溶液充分反应
溶液充分反应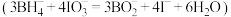 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗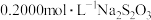 标准溶淮
标准溶淮 (发生反应
(发生反应 )。
)。①根据所给试剂,判断
 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为A.稀硫酸
B.
 溶液
溶液C.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)D.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)②加入“溶液X2”后,发生的主要反应的离子方程式为
③产品中
 的纯度为
的纯度为 。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果
您最近一年使用:0次
23-24高三上·山东·阶段练习
名校
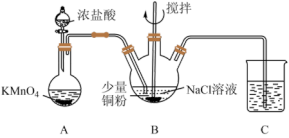
7 . CuCl在工业生产中有着重要应用。利用以下装置制备CuCl并测定产品纯度。
已知:Ⅰ.CuCl是白色固体,不溶于水和乙醇,在潮湿空气中可被迅速氧化。
Ⅱ.Na2[CuCl3]为无色溶液,加水稀释即析出CuCl白色固体。
(1)制取Cl2:该实验条件下可以替代装置A中KMnO4的物质有___________ (填标号,下同),
A.KClO3B.MnO2C.浓硫酸
为吸收Cl2尾气,装置C中不可选用试剂是___________ 。
A.Na2S溶液B.饱和食盐水C.FeCl2溶液D.饱和石灰水
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,装置B中依次发生反应的离子方程式为:
①Cu+Cl2=Cu2++2Cl-
②___________
③CuCl+2Cl- [CuCl3]2-
[CuCl3]2-
观察到___________ 时停止反应。将B中溶液倾入盛有蒸馏水的烧杯中,立即得到白色CuCl沉淀,抽滤得CuCl粗品。下述有关抽滤的描述错误的是___________ (填标号)。
A.过滤速率快,且得到的固体较为干燥
B.布氏漏斗的颈口斜面应与吸滤瓶支管口相对
C.结束时先关闭抽气系统再拔吸滤瓶的橡胶管
D.不宜过滤胶状沉淀或颗粒较小的沉淀
(3)洗涤CuCl:洗涤时最好用95%的乙醇洗涤滤饼3~4次,其目的是___________ 。
(4)CuCl纯度测定:称取所制备的氯化亚铜成品3.00g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用0.0200mol·L-1的K2Cr2O7溶液滴定至终点,再重复滴定2次,三次平均消耗K2Cr2O7溶液20.00mL(滴定过程中Cr2O 转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为
转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为___________ %。滴定时盛装K2Cr2O7溶液的仪器名称是___________ 。
已知:Ⅰ.CuCl是白色固体,不溶于水和乙醇,在潮湿空气中可被迅速氧化。
Ⅱ.Na2[CuCl3]为无色溶液,加水稀释即析出CuCl白色固体。
(1)制取Cl2:该实验条件下可以替代装置A中KMnO4的物质有
A.KClO3B.MnO2C.浓硫酸
为吸收Cl2尾气,装置C中不可选用试剂是
A.Na2S溶液B.饱和食盐水C.FeCl2溶液D.饱和石灰水
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,装置B中依次发生反应的离子方程式为:
①Cu+Cl2=Cu2++2Cl-
②
③CuCl+2Cl-
 [CuCl3]2-
[CuCl3]2-观察到
A.过滤速率快,且得到的固体较为干燥
B.布氏漏斗的颈口斜面应与吸滤瓶支管口相对
C.结束时先关闭抽气系统再拔吸滤瓶的橡胶管
D.不宜过滤胶状沉淀或颗粒较小的沉淀
(3)洗涤CuCl:洗涤时最好用95%的乙醇洗涤滤饼3~4次,其目的是
(4)CuCl纯度测定:称取所制备的氯化亚铜成品3.00g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用0.0200mol·L-1的K2Cr2O7溶液滴定至终点,再重复滴定2次,三次平均消耗K2Cr2O7溶液20.00mL(滴定过程中Cr2O
 转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为
转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为
您最近一年使用:0次
2024-01-02更新
|
569次组卷
|
4卷引用:T17-实验综合题
(已下线)T17-实验综合题山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题山东省名校联考2024届高三上学期模拟预测化学试题(已下线)化学(山东卷02)-2024年高考押题预测卷
名校
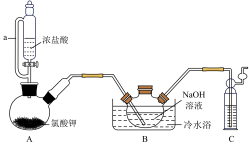
8 . 二氯异氰尿酸钠[(CNO)3Cl2Na]常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,装置如图所示(部分夹持装置略)。
(1)C中所装试剂为___________ (填化学式)
(2)A中反应的化学方程式为___________ 。
(3)待装置B中出现___________ 现象时,可由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是___________ 。
(4)反应结束后,装置B中的浊液经过滤、___________ 、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是___________ 。
(5)通过下列实验,可以测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:[(CNO)3Cl2]-+ H++ 2H2O = (CNO)3H3+ 2HClO;HClO + 2I-+ H+= I2+ Cl-+ H2O;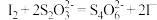 。
。
实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取12.50 mL上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应,用c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为V mL。
①滴定终点现象为___________ 。
②该样品的有效氯含量表达式为(化为最简式)___________ 。
(提示:该样品的有效氯=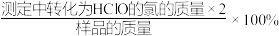 )
)
(1)C中所装试剂为
(2)A中反应的化学方程式为
(3)待装置B中出现
(4)反应结束后,装置B中的浊液经过滤、
(5)通过下列实验,可以测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:[(CNO)3Cl2]-+ H++ 2H2O = (CNO)3H3+ 2HClO;HClO + 2I-+ H+= I2+ Cl-+ H2O;
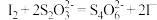 。
。实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取12.50 mL上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应,用c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为V mL。
①滴定终点现象为
②该样品的有效氯含量表达式为(化为最简式)
(提示:该样品的有效氯=
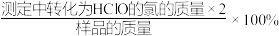 )
)
您最近一年使用:0次
2023-12-31更新
|
107次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
名校
9 . 稀土元素钪(Sc)广泛应用于航空航天、超导、激光、核能等领域,从钛白水解工业废酸(含 、
、 、
、 、
、 、
、 等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下: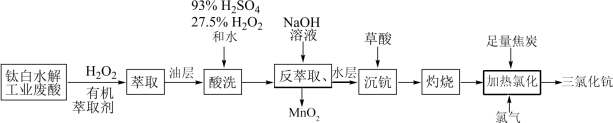
 为砖红色固体;
为砖红色固体; ,
,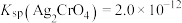 。
。请回答下列问题:
(1)萃取操作使用到的仪器如何检漏
(2)在钛白水解工业废酸中,加入
 是为了使
是为了使 转化为
转化为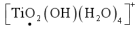 ,若该离子中Ti的化合价为+4价,则黑点标的氧元素价态为
,若该离子中Ti的化合价为+4价,则黑点标的氧元素价态为(3)若温度对钪、钛的萃取率影响情况见下表,一般合适的萃取温度为10~15℃,其理由是
| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(4)反萃取步骤中,强碱性条件下双氧水可以氧化锰离子生成MnO2,则该反应的离子方程式为
(5)上述工艺流程在“灼烧”步骤中可得到Sc2O3,已知在后续的“加热氯化”步骤中可得到一种使热的氧化铜由黑变红的气体,请依题写出此时由Sc2O3制备ScCl3的化学方程式:
(6)现取制得的ScCl3粗产品(只含难溶Sc2O3杂质)溶于水,配成溶液,采用K2CrO4为指示剂,用AgNO3标准溶液滴定,当达到滴定终点,溶液中Cl-恰好沉淀完全[假设此时c(Cl-)为
 ]时,则此时溶液中c(
]时,则此时溶液中c( )的浓度为
)的浓度为
您最近一年使用:0次
2023-12-31更新
|
356次组卷
|
4卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
名校
10 . 废旧金属的回收利用是重要研究课题。某小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的Al、Fe及其氧化物)生产胆矾,其实验方案如下:
(1)上述流程中,将废铜料“研磨”的目的是___________ 。
(2)操作1所得的滤液的主要成分是___________ 。
(3)请写出“酸溶”过程中单质铜主要发生反应的化学方程式___________ ,可以用另一种试剂替代氧气,该试剂是___________ 。
(4)调pH =5.2的目的是___________ 。
(5)为测定胆矾的纯度,称量5g胆矾固体配置成250 mL溶液,移取25.00 mL溶液,加入H2SO4溶液酸化,再加过量的KI溶液,混匀并放置,用0.1000mol/L Na2S2O3溶液滴定,至棕色较浅时加入淀粉溶液,继续滴至蓝紫色恰好消失,消耗16.00 mL,测得胆矾的纯度为___________ (已知:2Cu2++ 4I− = 2CuI↓ + I2;I2 + 2 = 2I− +
= 2I− +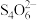 )。滴定过程中CuI表面会吸附I2,则该测定结果
)。滴定过程中CuI表面会吸附I2,则该测定结果___________ (填“偏大”、“偏小”或“无影响”)。
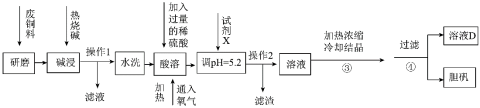
(1)上述流程中,将废铜料“研磨”的目的是
(2)操作1所得的滤液的主要成分是
(3)请写出“酸溶”过程中单质铜主要发生反应的化学方程式
(4)调pH =5.2的目的是
(5)为测定胆矾的纯度,称量5g胆矾固体配置成250 mL溶液,移取25.00 mL溶液,加入H2SO4溶液酸化,再加过量的KI溶液,混匀并放置,用0.1000mol/L Na2S2O3溶液滴定,至棕色较浅时加入淀粉溶液,继续滴至蓝紫色恰好消失,消耗16.00 mL,测得胆矾的纯度为
 = 2I− +
= 2I− +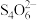 )。滴定过程中CuI表面会吸附I2,则该测定结果
)。滴定过程中CuI表面会吸附I2,则该测定结果
您最近一年使用:0次
2023-12-31更新
|
62次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷



