1 . 大苏打(Na2S2O3)是一种重要的化工产品,也是实验室常用试剂。某小组对大苏打展开如下探究。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:
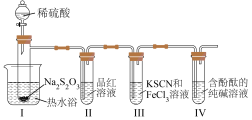
实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是_______ ,其他条件相同时,若拆去热水浴,试管Ⅱ中溶液褪色速率变_______ (填“快”或“慢”)。
(2)装置Ⅰ中的离子方程式为_______ 。
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为 的试剂是
的试剂是_______ 。由试管Ⅳ中现象可知,电离常数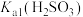
_______ (填“>”“<”或“=”) 。
。
实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
(4)
_______ 。
(5)实验记录: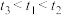 。由实验①②得出的结论是
。由实验①②得出的结论是_______ 。设计实验①③的目的是_______ 。
实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示: 。
。
(6)Na2S2O3∙xH2O中x为_______ 。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:

实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是
(2)装置Ⅰ中的离子方程式为
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为
 的试剂是
的试剂是
 。
。实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
| 编号 | 0.1mol∙L-1 Na2S2O3溶液的体积/mL | 0.1mol∙L-1 H2SO4溶液的体积/mL | 水的体积/mL | 水浴温度/℃ | 测定变浑浊时间/s |
| ① | 10.0 | 15.0 | 0 | 35 |  |
| ② | 10.0 | 10.0 |  | 35 |  |
| ③ |  | 15.0 | 0 | 45 |  |
(4)

(5)实验记录:
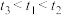 。由实验①②得出的结论是
。由实验①②得出的结论是实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示:
 。
。(6)Na2S2O3∙xH2O中x为
您最近一年使用:0次
2023-12-15更新
|
195次组卷
|
5卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期11月份考试化学试卷
名校
2 . 无水四氯化锡( )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中 含量。
含量。 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。
②Sn熔点为232℃,无水 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。
回答下列问题:
(1)a管的作用是___________ 。
(2)装置B、C中的试剂分别为___________ 、___________ (填名称)。
(3)为了获得较纯的产品,当D处具支试管中___________ 时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为___________ 。
(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。___________ 。
(5)碘氧化法滴定分析产品中 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中 的质量分数为
的质量分数为___________ (用含a、b、V的代数式表示)。
 )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中 含量。
含量。
 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。②Sn熔点为232℃,无水
 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。回答下列问题:
(1)a管的作用是
(2)装置B、C中的试剂分别为
(3)为了获得较纯的产品,当D处具支试管中
 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。

(5)碘氧化法滴定分析产品中
 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-05更新
|
255次组卷
|
5卷引用:广西钦州市第四中学2023-2024学年高三上学期12月考试化学试卷
名校
3 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为
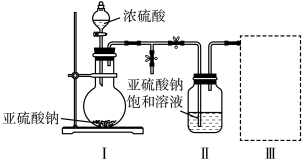
(1)装置Ⅰ中产生气体的化学方程式为___________ 。
(2)要从装置Ⅱ中获得已析出的晶体,采取的分离方法是___________ 分离时需用到的玻璃仪器有___________ 。
(3)装置Ⅲ中用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___________ (填编号)。
a.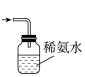 b.
b.  c.
c.  d.
d. 
实验二:焦亚硫酸钠的性质:Na2S2O5溶于水即生成
(4)证明 溶液中
溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填编号)。
a.测定溶液的pH b.加入 溶液 c.加入盐酸
溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是___________ 。
实验三:葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离的 计算)的方案如下:
计算)的方案如下:
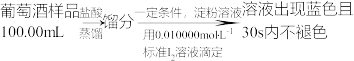
(已知滴定时反应的化学方程式为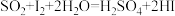 )
)
①按上述方案实验,消耗标准 溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的
溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的 计算)为
计算)为___________ g/L。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果___________ (填“偏高”“偏低”或“不变”)。
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为


(1)装置Ⅰ中产生气体的化学方程式为
(2)要从装置Ⅱ中获得已析出的晶体,采取的分离方法是
(3)装置Ⅲ中用于处理尾气,可选用的最合理装置(夹持仪器已略去)为
a.
 b.
b.  c.
c.  d.
d. 
实验二:焦亚硫酸钠的性质:Na2S2O5溶于水即生成
(4)证明
 溶液中
溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入
 溶液 c.加入盐酸
溶液 c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三:葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离的
 计算)的方案如下:
计算)的方案如下: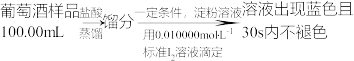
(已知滴定时反应的化学方程式为
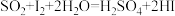 )
)①按上述方案实验,消耗标准
 溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的
溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的 计算)为
计算)为②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近一年使用:0次
名校
4 . 已知常温下水溶液中 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如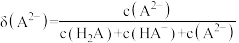 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中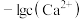 和
和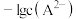 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
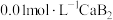 溶液,下列说法错误的是
溶液,下列说法错误的是
 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如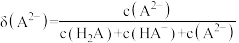 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中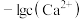 和
和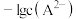 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
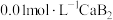 溶液,下列说法错误的是
溶液,下列说法错误的是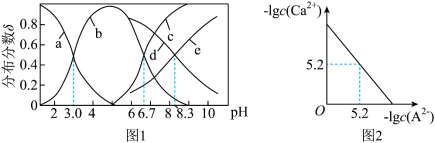
A.曲线b表示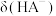 |
B. 溶液中存在: 溶液中存在: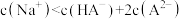 |
C.反应 的平衡常数 的平衡常数 |
D.滴定过程中始终存在: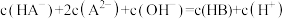 |
您最近一年使用:0次
2024-05-24更新
|
89次组卷
|
2卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
名校
5 . 常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol⋅L-1  溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知
溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知 溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)
溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)
 溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知
溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知 溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)
溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)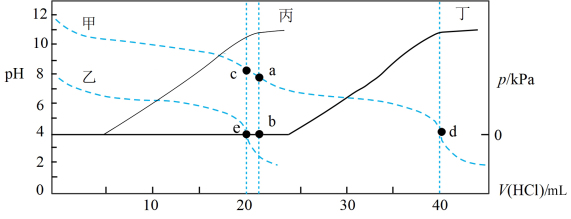
| A.图中曲线乙和丙代表向NaHA溶液中滴加盐酸 |
B.由图可知,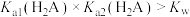 |
C.a点溶液中存在: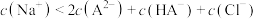 |
| D.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂 |
您最近一年使用:0次
2023-12-22更新
|
138次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
6 . 常温下向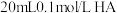 溶液中逐滴加入
溶液中逐滴加入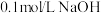 溶液,其
溶液,其 变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
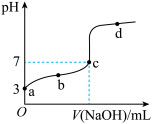
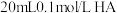 溶液中逐滴加入
溶液中逐滴加入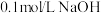 溶液,其
溶液,其 变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
A.由题可知 为弱酸 为弱酸 |
| B.c点时,酸过量 |
C.滴定到b点时, |
D.滴定到d点时,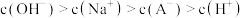 |
您最近一年使用:0次
名校
解题方法
7 . 某温度下,0.100mol/LNaOH滴定50.0mL0.0500mol/LHCl溶液的滴定曲线如图所示。设该温度下水的离子积为Kw。下列说法错误的是
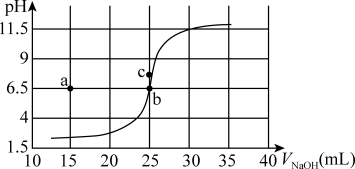

| A.根据曲线数据计算可知该温度下Kw为10-13 |
| B.曲线上各点的溶液满足关系式c(H+)·c(OH—)=Kw |
| C.其它条件相同,若降温,反应终点b向c方向移动 |
| D.相同实验条件下,若改为滴定0.0200mol·L-1H2SO4,反应终点b移到a |
您最近一年使用:0次
2021-06-01更新
|
1975次组卷
|
12卷引用:广西玉林市博白县中学2023-2024学年高三上学期10月月考化学试题
广西玉林市博白县中学2023-2024学年高三上学期10月月考化学试题天津市第一中学2022-2023学年高二上学期月考化学试题重庆市育才中学2023-2024学年高二上学期10月月考化学试题广东省广州市华南师范大学附属中学2021届高三下学期三模化学试题(已下线)第24讲 水的电离和溶液的pH(精练)-2022年高考化学一轮复习讲练测黑龙江省密山市第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省大庆实验中学2021-2022学年高二上学期期中考试化学试题黑龙江省鹤岗市第三中学2021-2022学年高二下学期开学考试化学试题湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题广东省广州市华南师范大学附属中学2022届高三上学期综合测试(一)化学试题江西省宜春市宜丰中学2022-2023学年高三上学期1月期末考试化学试题【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1



