2018高二上·全国·专题练习
名校
解题方法
1 . 实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1〜4.4,石蕊:5.0〜8.0,酚酞:8.2〜10.0。用0.100 0 mol·L−1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时溶液呈碱性,下列叙述中正确的是
| A.可选用甲基橙或酚酞作指示剂 |
| B.只能选用石蕊作指示剂 |
| C.可选用石蕊或酚酞作指示剂 |
| D.只能选用酚酞作指示剂 |
您最近一年使用:0次
2 . 常温下,向浓度均为01mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg 随加入NaOH的物质的量的变化如图所示。下列说法正确的是
随加入NaOH的物质的量的变化如图所示。下列说法正确的是

 随加入NaOH的物质的量的变化如图所示。下列说法正确的是
随加入NaOH的物质的量的变化如图所示。下列说法正确的是
| A.a点溶液的ph=2 |
| B.水的电离程度:a<b<c |
| C.b点溶液中:c(Yˉ)+c(HY)=c(Na+) |
| D.c点溶液中:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ) |
您最近一年使用:0次
名校
3 . 常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是
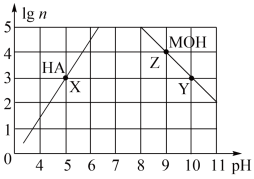

| A.MOH为弱碱,HA为强酸 |
| B.水的电离程度:X=Z>Y |
| C.若升高温度,Y、Z点对应溶液的pH均不变 |
| D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
您最近一年使用:0次
2018-04-14更新
|
1515次组卷
|
15卷引用:云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题宁夏银川市2018届高三4月高中教学质量检测理科综合化学试题【百强校】天津市静海区第一中学2020届高三下学期第七周周末训练化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题广东省佛山市第一中学2021-2022学年高二上学期期中考试化学(选考) 试题湖南省怀化市沅陵县第一中学2021-2022学年高三下学期期中考试化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第三次月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题
名校
4 . 表1是元素周期表的一部分:

25℃时,用浓度为0.1000 mol•L-1的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000 mol•L-1 的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是

25℃时,用浓度为0.1000 mol•L-1的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000 mol•L-1 的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是
| A.通过分析可得表格中a <7,b=7 |
| B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大 |
| C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强 |
| D.0.1000 mol•L-1 Na2Y的水溶液中:c(Y2-) + c(HY-) + c(H2Y) = 0.1000 mol•L-1 |
您最近一年使用:0次
名校
5 . 化学上常用AG表示溶液的lg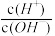 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是

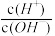 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
| A.C点时,加入NaOH溶液的体积不为20mL |
| B.D点溶液的pH=11.25 |
| C.B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2) |
| D.25℃时,HNO2的电离常数Ka=1.0×10-5.5 |
您最近一年使用:0次
2018-01-16更新
|
473次组卷
|
2卷引用:云南省师范大学附属中学2018届高三高考适应性月考卷(六)理综化学试题
名校
6 . 用标准浓度的NaOH溶液滴定未知浓度的盐酸时下列情况会使盐酸物质的量浓度偏低的是( )
| A.碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 |
| B.碱式滴定管尖端有气泡,滴定后气泡消失 |
| C.记录消耗的碱液,滴定前平视,滴定后俯视凹液面 |
| D.锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸 |
您最近一年使用:0次
2017-11-17更新
|
861次组卷
|
14卷引用:云南省永德县第一中学2019-2020学年高二12月月考化学试题
云南省永德县第一中学2019-2020学年高二12月月考化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题宁夏育才中学2017-2018学年高二上学期期中化学试题宁夏育才中学2017-2018学年高二上学期期中考试化学试题甘肃省岷县二中2018-2019学年高二上学期第三次月考化学试题河南省洛阳市栾川县实验高中2019-2020学年高二9月月考化学试题贵州省龙里中学2019-2020学年高二上学期期末考试化学试题内蒙古包钢第一中学2019-2020学年高二上学期10月月考化学试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时3 酸碱中和滴定四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题(已下线)3.2.2 pH计算和酸碱中和滴定-同步学习必备知识广东省深圳市龙华高级中学2022-2023学年高二上学期第二次段考化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题江苏省无锡市江阴市两校联考2023-2024学年高二下学期3月月考化学试题
名校
7 . 下列说法正确的是
| A.0.1 mol·L-1pH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-) |
B.如下图表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1 NaOH溶液时,溶液的pH随加入酸体积的变化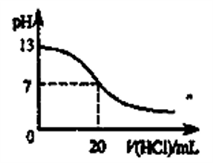 |
| C.在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-) |
D.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy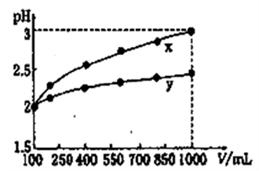 |
您最近一年使用:0次
2017-10-28更新
|
956次组卷
|
7卷引用:云南省峨山彝族自治县第一中学2018届高三第四次模拟考试化学试题
名校
解题方法
8 . 一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。若要配制1 mol·L-1的稀硫酸标准溶液,用其滴定某未知浓度的NaOH溶液。下列有关说法错误的是( )
| A.实验中用到的滴定管和容量瓶使用前都需要检漏 |
| B.如果实验需用85 mL的稀硫酸标准溶液,配制时可选用100 mL容量瓶 |
| C.用甲基橙作指示剂,滴定终点时,溶液颜色从红色变为橙色 |
| D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸滴定,会导致测定的NaOH溶液浓度偏大 |
您最近一年使用:0次
2017-08-20更新
|
967次组卷
|
5卷引用:云南省临沧市第一中学2018届高三上学期期末考试化学试题
名校
解题方法
9 . 某化学小组设计了如图1所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图2所示,则下列说法中不正确的是
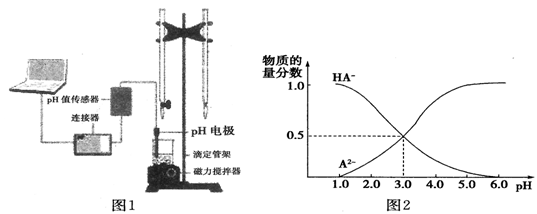

| A.pH=4.0时,图中n(HA-)约为0.0091mol |
| B.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂 |
| C.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 |
| D.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
您最近一年使用:0次
2016-12-09更新
|
299次组卷
|
7卷引用:云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题
13-14高三·浙江温州·开学考试
名校
解题方法
10 . 常温下,用 0.10 mol·L-1NaOH溶液分别滴定20.00 mL 0.10 mol·L-1HCl溶液和20.00 mL 0.10 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是
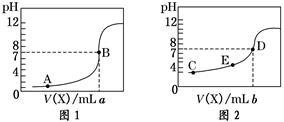

| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-) >c(Na+) >c(H+) >c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |
您最近一年使用:0次
2016-12-09更新
|
486次组卷
|
3卷引用:云南省楚雄市楚雄实验中学2018—2019学年高二上学期12月月考化学试题
云南省楚雄市楚雄实验中学2018—2019学年高二上学期12月月考化学试题(已下线)2015届浙江省“温州八校”高三返校联考化学试卷安徽省六安市第一中学2020-2021学年高二上学期第一次段考化学试题



