名校
解题方法
1 . 常温下,已知 溶液中含A元素的粒子浓度之和为
溶液中含A元素的粒子浓度之和为 ,溶液中各含A元素的粒子的pc-pOH关系所示。图中pc表示各含A粒子浓度的负对数(
,溶液中各含A元素的粒子的pc-pOH关系所示。图中pc表示各含A粒子浓度的负对数( ),pOH表示
),pOH表示 浓度的负对数[
浓度的负对数[ ];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是
];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是

 溶液中含A元素的粒子浓度之和为
溶液中含A元素的粒子浓度之和为 ,溶液中各含A元素的粒子的pc-pOH关系所示。图中pc表示各含A粒子浓度的负对数(
,溶液中各含A元素的粒子的pc-pOH关系所示。图中pc表示各含A粒子浓度的负对数( ),pOH表示
),pOH表示 浓度的负对数[
浓度的负对数[ ];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是
];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是
A.曲线①表示 随pOH的变化 随pOH的变化 |
| B.x点到z点对应的变化过程中,溶液中水的电离程度先减小再增大 |
C.pH=4的溶液中: |
D.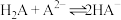 的平衡常数的数量级为 的平衡常数的数量级为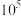 |
您最近一年使用:0次
2024-02-23更新
|
314次组卷
|
3卷引用:河北省邯郸市2024届高三第二次调研监测化学试题
名校
2 . 某实验室回收废水中苯酚的过程如下图所示。已知:苯酚的电离常数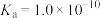 ,H2CO3的电离常数
,H2CO3的电离常数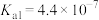 ,
, 。
。
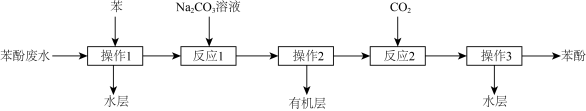
下列有关说法不正确的是
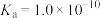 ,H2CO3的电离常数
,H2CO3的电离常数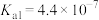 ,
, 。
。
下列有关说法不正确的是
| A.操作1、操作2 均为分液 |
B. NaHCO3溶液中存在:c(H2CO3)+c(H+)=c(OH-)+c( NaHCO3溶液中存在:c(H2CO3)+c(H+)=c(OH-)+c( ) ) |
C.若反应1后溶液中存在c(Na+)=2 c(C6H5O-)+2 c(C6H5OH),此时c(C6H5O-)>c( ) ) |
| D.反应2 中通入CO2至溶液 pH=10时, 此时溶液中存在: c(C6H5O-)= c(C6H5OH) |
您最近一年使用:0次
名校
3 . 已知25℃时有关弱酸的电离平衡常数
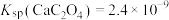 。
。
则下列有关说法正确的是
| 弱酸 | 氢氟酸 | 碳酸( ) ) | 草酸( ) ) | 柠檬酸(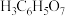 ) ) |
| 电离平衡常数/25℃ |  | 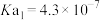  | 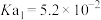 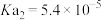 | 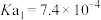 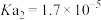  |
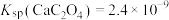 。
。则下列有关说法正确的是
A.溶液pH由小到大为 、NaF、 、NaF、 |
B.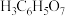 与 与 溶液反应的产物可能为 溶液反应的产物可能为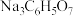 与 与 、 、 |
C.0.05mol/L的 溶液存在: 溶液存在: |
D.往20mL0.1mol/L 溶液中滴加60mL0.1mol/L 溶液中滴加60mL0.1mol/L 溶液,最后溶液中 溶液,最后溶液中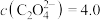  mol/L mol/L |
您最近一年使用:0次
解题方法
4 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)下列生产、生活活动中,不易产生 的是___________。
的是___________。
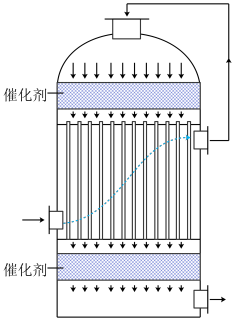
(2)工业中可用含 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
(3)研究 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是___________ 。
钠碱法的启动吸收剂为 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。
(4)常温下进行“钠碱法”的模拟实验。用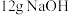 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为___________ L(折算成标准状况)。若实验时只吸收了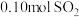 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为___________ 。
(5)当钠碱法的吸收液 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是________ (填写化学式)。
(6)将 通入
通入 溶液时,得到一组
溶液时,得到一组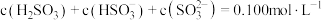 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
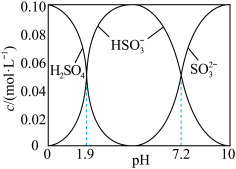
若溶液的 ,溶液中
,溶液中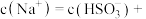
___________ ,此时溶液中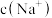
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数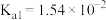 ,
,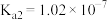 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价_____ 。
(1)下列生产、生活活动中,不易产生
 的是___________。
的是___________。| A.燃放鞭炮 | B.火力发电 | C.火山爆发 | D.海水晒盐 |
(2)工业中可用含
 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
| A.充分利用热能 | B.防止形成酸雾 | C.加速转化 | D.获取纯净 |
(3)研究
 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是 |  |  |  |
A.制取 | B.收集 | C.验证 水溶液的酸性 水溶液的酸性 | D.验证 的还原性 的还原性 |
钠碱法的启动吸收剂为
 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。(4)常温下进行“钠碱法”的模拟实验。用
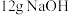 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为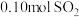 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为(5)当钠碱法的吸收液
 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是(6)将
 通入
通入 溶液时,得到一组
溶液时,得到一组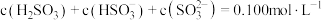 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
若溶液的
 ,溶液中
,溶液中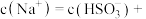
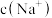
 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数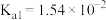 ,
,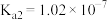 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为
 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
您最近一年使用:0次
5 . 25℃时,向20 mL 0.1 mol·L−1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L−1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
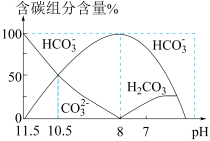
| A.pH = 8时,溶液中水的电离程度最大 |
B.当溶液中c(HCO ):c(CO ):c(CO ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) |
C.在同一溶液中,H2CO3、HCO 、CO 、CO 能大量共存 能大量共存 |
D.pH = 7时,溶液中离子浓度大小关系为:c(Na+) > c(HCO ) > c(Cl−) ) > c(Cl−) |
您最近一年使用:0次
2023-12-31更新
|
883次组卷
|
6卷引用:2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题
2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)宁夏开元学校2023-2024学年高二上学期期末考试化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷
6 . 常温下,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
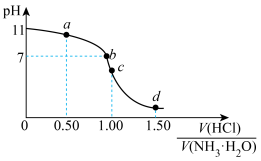
 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
A. 时, 时,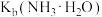 的数量级为 的数量级为 |
B. 点溶液中: 点溶液中: |
C.水的电离程度: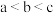 |
D. 点溶液中: 点溶液中: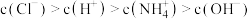 |
您最近一年使用:0次
2023-12-13更新
|
128次组卷
|
2卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
名校
7 . 已知 的电离方程式为
的电离方程式为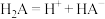 ,
, ,常温下,测得
,常温下,测得 溶液的
溶液的 为
为 。下列说法错误的是(不考虑溶液体积变化)
。下列说法错误的是(不考虑溶液体积变化)
 的电离方程式为
的电离方程式为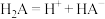 ,
, ,常温下,测得
,常温下,测得 溶液的
溶液的 为
为 。下列说法错误的是(不考虑溶液体积变化)
。下列说法错误的是(不考虑溶液体积变化)A. |
B. 溶液中 溶液中 |
C.向 溶液中滴加同浓度NaOH溶液至中性时: 溶液中滴加同浓度NaOH溶液至中性时: |
D.向 溶液中滴加 溶液中滴加 溶液至恰好完全中和时: 溶液至恰好完全中和时:  |
您最近一年使用:0次
2023-12-13更新
|
306次组卷
|
3卷引用:河南省部分学校2023-2024学年高三上学期12月大联考模拟预测化学试题
名校
解题方法
8 . 有机反应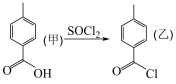 过程中还有
过程中还有 和
和 生成,下列叙述正确的是
生成,下列叙述正确的是
 过程中还有
过程中还有 和
和 生成,下列叙述正确的是
生成,下列叙述正确的是| A.乙的沸点高于甲的沸点 |
| B.H—Cl键的键能大于H—F键的键能 |
C.键角: |
D.甲的电离常数小于 的电离常数 的电离常数 |
您最近一年使用:0次
2023-12-13更新
|
335次组卷
|
4卷引用:河南省部分学校2023-2024学年高三上学期12月大联考模拟预测化学试题
名校
解题方法
9 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径、CO、捕获与CO2重整是CO2利用的研究热点,
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则 △H=
△H=________ kJ∙mol−1。
(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:_____ T2(填“>”“<”或“=”),依据为________ ;
②图中a=________ ;
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为________ 。
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液

 溶液pH=
溶液pH=_____ (室温下,
 的
的
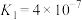 ;
;
 )。
)。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是___________ 。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
| 共价键 | C=O | C-O | H-H | H-O | C-H |
| 键能/(kJ·mol⁻¹) | 799 | 343 | 436 | 463 | 413 |
 △H=
△H=(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为

 溶液pH=
溶液pH= 的
的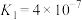 ;
; )。
)。(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是
您最近一年使用:0次
2023-10-29更新
|
376次组卷
|
2卷引用:内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题
名校
10 . 室温下,某混合溶液中c(M⁺) +c(MOH)=c(R⁻) +c(HR), 和
和 随pH 变化关系如图所示,已知pX =-lg X。下列说法不正确的是
随pH 变化关系如图所示,已知pX =-lg X。下列说法不正确的是
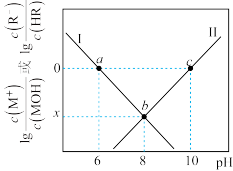
 和
和 随pH 变化关系如图所示,已知pX =-lg X。下列说法不正确的是
随pH 变化关系如图所示,已知pX =-lg X。下列说法不正确的是
A.曲线I表示 与pH关系曲线, 与pH关系曲线,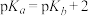 |
| B.b点溶液中c(M+)>c(R-), x=-4 |
| C.MR 溶液显碱性, 且MR溶液中c(MOH)<c( HR) |
D.等物质的量的 NaR 与 HR 混合溶液中: |
您最近一年使用:0次
2023-10-29更新
|
842次组卷
|
2卷引用:内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题



