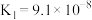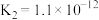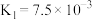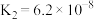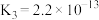解题方法
1 . 用下列装置进行实验,不能达到实验目的的是
| 选项 | A | B | C | D |
| 实验装置 | 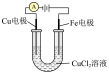 |  | 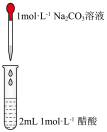 | 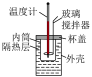 |
| 实验目的 | 铁电极上镀铜 | 探究压强对化学平衡的影响 | 比较 的 的 与 与 的 的 的大小 的大小 | 测定盐酸与NaOH反应的中和热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列反应的离子方程式表示错误的是
A.泡沫灭火器的反应原理: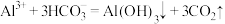 |
B.硝酸银溶液中加入足量稀氨水: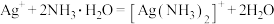 |
C.少量 通入 通入 溶液中: 溶液中: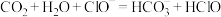 |
D.硫化氢通入 溶液中: 溶液中: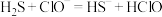 |
您最近一年使用:0次
2024-02-02更新
|
68次组卷
|
2卷引用:山东省济南市2023-2024学年高二上学期1月期末化学试题
3 . 食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫___________ ,乙酸的官能团是___________ (写名称).
(2)实验室常用图装置制备乙酸乙酯.
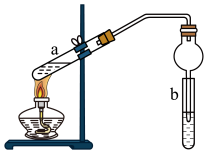
①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是___________ ,浓硫酸的作用是___________ ,a试管中主要反应的化学方程式为______________________________ .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________ .
(3)醋酸能除水垢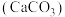 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________________ .
(4) ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
①
___________ ;②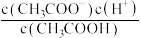
___________ ;③
___________ .
(5)室温下,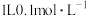 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为___________ .
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫
(2)实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(3)醋酸能除水垢
 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)
 ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①

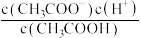

(5)室温下,
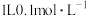 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为
您最近一年使用:0次
名校
4 . 按要求完成下列试题:
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,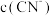
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A. 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填编号)。
③室温下,一定浓度的 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=___________ 。
④将少量 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是___________ 。
(2)室温下, 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中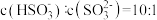 ,溶液的pH=
,溶液的pH=___________ 。(室温下, 的
的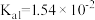 ;
; )
)
II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为_______ ;B的原子核外电子运动状态有_________ 种,
(4)C的最外层电子排布式为________ ;D的原子结构示意图为________ 。
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  | HCN |  |
| 电离常数(25℃) |  | 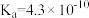 |  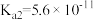 |
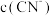
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:A.
 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是③室温下,一定浓度的
 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=④将少量
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是(2)室温下,
 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中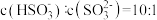 ,溶液的pH=
,溶液的pH= 的
的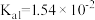 ;
; )
)II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为
(4)C的最外层电子排布式为
您最近一年使用:0次
名校
5 .  时,
时, 的电离常数
的电离常数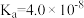 ,
, 的电离常数
的电离常数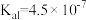 、
、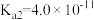 。下列说法
。下列说法不正确 的是
 时,
时, 的电离常数
的电离常数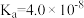 ,
, 的电离常数
的电离常数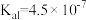 、
、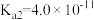 。下列说法
。下列说法A. 溶液和 溶液和 溶液中离子种类相同 溶液中离子种类相同 |
B. 时,反应 时,反应 的 的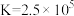 |
C. ,物质的量浓度相同的 ,物质的量浓度相同的 溶液与 溶液与 溶液的 溶液的 :前者小于后者 :前者小于后者 |
D.向氯水中加入少量 固体, 固体, 增大 增大 |
您最近一年使用:0次
2023-05-07更新
|
552次组卷
|
3卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
2022·上海松江·一模
解题方法
6 . 将4份等量的铝片分别加到足量的下列溶液中充分反应后,产生氢气量最快的是
A. 溶液 溶液 | B. 溶液 溶液 |
C.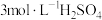 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
7 . 下列离子方程式错误的是
A.向饱和碳酸钠溶液中通入过量二氧化碳:2Na++CO +CO2+H2O=2NaHCO3↓ +CO2+H2O=2NaHCO3↓ |
B.氢氧化钠溶液吸收处理SO2尾气:2OH-+SO2=SO +H2O +H2O |
C.漂白液中通入少量CO2:2ClO-+CO2+H2O=CO +2HClO +2HClO |
| D.将过量氯气通入FeI2溶液中:2Fe2++4I-+3Cl2=2I2+2Fe3++6Cl- |
您最近一年使用:0次
2022-05-14更新
|
1418次组卷
|
4卷引用:四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题
21-22高二上·湖北武汉·期末
名校
8 . 已知25℃时,部分弱电解质的电离平衡常数如表:
下列离子方程式或守恒关系正确的是
| 弱电解质 | HClO | H2CO3 | H2SO3 | NH3·H2O |
| 电离平衡常数 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.5×10-2 Ka2=6.0×10-8 | Kb=1.75×10-5 |
A.将Cl2通入到过量Na2CO3溶液中:Cl2+H2O+CO =HCO =HCO +HClO+Cl- +HClO+Cl- |
B.将SO2通入到NaClO溶液中:ClO-+H2O+SO2=HClO+HSO |
C.向亚硫酸溶液中加入氨水至中性:c(NH )=c(SO )=c(SO )+c(H2SO3)+c(HSO )+c(H2SO3)+c(HSO ) ) |
D.向过量Na2CO3溶液中通入少量SO2:SO2+H2O+2CO =2HCO =2HCO +SO +SO |
您最近一年使用:0次
2022-03-13更新
|
349次组卷
|
3卷引用:选择题1-5
9 . 水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_____ mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
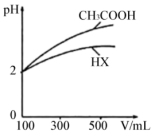
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是___________ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol·L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
7卷引用:四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题河南省洛阳市2019-2020学年高二上学期期末考试化学试题(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题江西省吉安市2021-2022学年高二上学期期末教学质量检测化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题
名校
10 . 下表是几种弱酸常温下的电离平衡常数:
则下列说法中不正确的是
|
|
|
|
|
|
|
|
| A.碳酸的酸性强于氢硫酸 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.常温下,加水稀释醋酸, 增大 增大 |
| D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变 |
您最近一年使用:0次
2021-12-02更新
|
414次组卷
|
21卷引用:江苏省无锡市江阴市两校联考2023-2024学年高二下学期3月月考化学试题
江苏省无锡市江阴市两校联考2023-2024学年高二下学期3月月考化学试题河北省邯郸市永年县第二中学2017-2018学年高二10月月考化学试题河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题黑龙江省大庆铁人中学2019-2020学年高二10月月考化学试题湖北省黄冈市2019-2020学年高二10月月考化学试题吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——弱电解质的电离四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题(已下线)3.1.3 常见的弱电解质(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆中学2021届高三上学期期中考试化学试题四川省峨眉第二中学2020-2021学年高二下学期4月月考化学试题江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题江西省宜春市万载中学2021-2022学年高一下学期第二次月考化学试题福建省泉州市石狮市石光中学2022-2023学年高二上学期期中考试化学试题河南省宏力学校2021-2022学年高二上学期期末考试化学试题