名校
1 . 已知: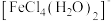 为黄色,溶液中可以存在可逆反应:
为黄色,溶液中可以存在可逆反应: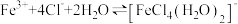 ,下列实验所得结论不正确的是
,下列实验所得结论不正确的是
(溶液中有少量的 时呈浅黄色;加热为微热,忽略体积变化)
时呈浅黄色;加热为微热,忽略体积变化)
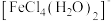 为黄色,溶液中可以存在可逆反应:
为黄色,溶液中可以存在可逆反应: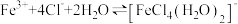 ,下列实验所得结论不正确的是
,下列实验所得结论不正确的是(溶液中有少量的
 时呈浅黄色;加热为微热,忽略体积变化)
时呈浅黄色;加热为微热,忽略体积变化)| ① | ② | ③ | ④ |
 |  |  |  |
| 加热前溶液为浅加热黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
A.实验①中, 溶液显浅黄色原因是 溶液显浅黄色原因是 水解产生了少量 水解产生了少量 |
B.实验②中,酸化对 水解的影响程度大于温度的影响 水解的影响程度大于温度的影响 |
C.实验③中,加热,可逆反应: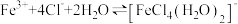 正向移动 正向移动 |
D.实验④,可证明升高温度,颜色变深一定是因为 水解平衡正向移动 水解平衡正向移动 |
您最近一年使用:0次
2021-10-14更新
|
1880次组卷
|
10卷引用:安徽省滁州市定远县育才学校2021-2022学年高二(实验班)上学期第三次月考化学试题
安徽省滁州市定远县育才学校2021-2022学年高二(实验班)上学期第三次月考化学试题北京市首都师范大学附属中学2021-2022学年高二上学期10月月考化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)周末培优3 盐类的水解-2021-2022学年高二化学课后培优练(人教版选修4)2021年北京高考化学试题变式题11-19江苏省天一中学2021-2022学年高二上学期期末考试化学试题全书综合测评2内蒙古乌兰浩特第一中学2022-2023学年高二上学期第三次月考化学试题广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题河南省南阳市第一中学校2022-2023学年高二上学期12月月考化学试题
名校
解题方法
2 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取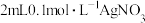 溶液,先后滴加3滴 溶液,先后滴加3滴 溶液和5滴 溶液和5滴 溶液,观察沉淀情况 溶液,观察沉淀情况 | 比较 、 、 的大小 的大小 |
| D | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验 样品是否变质 样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-08-01更新
|
800次组卷
|
7卷引用:安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题
安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题选择性必修1(SJ)专题3专题综合检测(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷河南省中原名校2021-2022学年高二上学期期末联考化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题
3 . 下表中实验操作、现象与结论对应关系错误的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 分别向两份相同的 溶液中加入少量等体积等浓度 溶液中加入少量等体积等浓度 ,溶液和 ,溶液和 溶液 溶液 | 加 溶液的试管中产生气体速率快 溶液的试管中产生气体速率快 |  催化效率大于 催化效率大于 |
| B | 用 试纸测定 试纸测定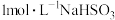 溶液的酸碱性 溶液的酸碱性 | 测得 |  的电离程度大于水解程度 的电离程度大于水解程度 |
| C | 向含有酚酞的 溶液中加入少量 溶液中加入少量 溶液 溶液 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由 水解引起的 水解引起的 |
| D | 在过量的 溶液中滴加少量 溶液中滴加少量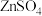 溶液,再加入少量 溶液,再加入少量 溶液 溶液 | 先产生白色 沉淀,后产生黑色 沉淀,后产生黑色 沉淀 沉淀 | 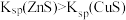 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 某班同学用如下实验探究Fe2+、Fe3+的性质。
请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液.在FeCl2溶液中需加入少量铁屑,其目的是____ 。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为:___ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___ 。
(4)丙组同学取l0mL0.lmol·L-1KI溶液,加入6mL0.lmol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号)___ ;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号)____ ,由此可以证明该氧化还原反应为___ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是___ ;生成沉淀的原因是(用平衡移动原理解释)____ 。
(6)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2废液中:c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为___ 。
②完成NaClO3氧化FeCl2的离子方程式:___ 。
 ClO
ClO +
+ Fe2++
Fe2++ ___=
___= Cl-+
Cl-+ Fe3++
Fe3++ ___
___
③FeCl3具有净水作用,其原理是___ 。
请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液.在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为:
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取l0mL0.lmol·L-1KI溶液,加入6mL0.lmol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号)
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
(6)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2废液中:c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为
②完成NaClO3氧化FeCl2的离子方程式:
 ClO
ClO +
+ Fe2++
Fe2++ ___=
___= Cl-+
Cl-+ Fe3++
Fe3++ ___
___③FeCl3具有净水作用,其原理是
您最近一年使用:0次
5 . 回答下列问题:
(1)已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11 CH3COOH:Ka=1.8×10-5 NH3·H2O:Kb=1.8×10-5
①常温下,0.1mol·L-1Na2S溶液和0.1mol·L-1Na2CO3溶液,碱性更强的是______ ,其原因是_______ 。
②25℃时,CH3COONH4溶液显______ 性。NaHCO3溶液的pH______ (填“大于”或“小于”)CH3COONa溶液的pH。
③NH4HCO3溶液显______ 性,原因是_______ 。
(2)25 ℃时,H2SO3⇌HSO +H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=___ ;若向NaHSO3溶液中加入少量的I2,则溶液中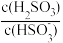 将
将______ (填“增大”“减小”或“不变”)。
(3)能证明Na2SO3溶液中存在SO +H2O⇌HSO
+H2O⇌HSO +OH-水解平衡的事实是
+OH-水解平衡的事实是_____ (填字母,下同)。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)已知:Ka(HClO2)=1.1×10-2,Ka(CH3COOH)=1.8×10-5。25℃时,浓度均为0.1mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO )
)______ (填“>”“<”或“=”)c(CH3COO-)。若要使两溶液的pH相等应________ 。
a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
(5)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_______ (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是________ 。
(1)已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11 CH3COOH:Ka=1.8×10-5 NH3·H2O:Kb=1.8×10-5
①常温下,0.1mol·L-1Na2S溶液和0.1mol·L-1Na2CO3溶液,碱性更强的是
②25℃时,CH3COONH4溶液显
③NH4HCO3溶液显
(2)25 ℃时,H2SO3⇌HSO
 +H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=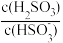 将
将(3)能证明Na2SO3溶液中存在SO
 +H2O⇌HSO
+H2O⇌HSO +OH-水解平衡的事实是
+OH-水解平衡的事实是A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)已知:Ka(HClO2)=1.1×10-2,Ka(CH3COOH)=1.8×10-5。25℃时,浓度均为0.1mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO
 )
)a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
(5)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是
您最近一年使用:0次
2020-12-09更新
|
407次组卷
|
2卷引用:安徽省肥东县高级中学2020-2021学年高二上学期期中考试化学试题
名校
6 . 物质在水中可能存在电离平衡、盐的水解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、OH-、___ 。(填写微粒符号)
(2)碳酸钠溶液呈碱性的原因是(用离子方程式表示)___ ;为证明你的上述观点,请设计一个简单的实验,简述实验过程___ 。
(3)实验室在配制的FeCl3溶液时,常将FeCl3固体先溶于较浓的___ 中,然后再用蒸馏水稀释到所需的浓度,把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___ 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4、溶液中c(NH4+)从大到小的顺序为:___ (填序号)。
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、OH-、
(2)碳酸钠溶液呈碱性的原因是(用离子方程式表示)
(3)实验室在配制的FeCl3溶液时,常将FeCl3固体先溶于较浓的
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4、溶液中c(NH4+)从大到小的顺序为:
您最近一年使用:0次
名校
7 . 某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
ⅰ.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O [Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
ⅱ.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验Ⅰ】

【实验Ⅱ】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验Ⅰ中,试管②溶液褪色的原因是_________________________________________ 。
(2)实验Ⅰ中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是_____________________________________________________________________________ 。
(3)由实验Ⅱ图甲、乙可知:加热时,溶液颜色________ (填“变浅”“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
【结论一】FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O [Fe(H2O)6]3++4Cl-得出此结论的理由是
[Fe(H2O)6]3++4Cl-得出此结论的理由是_______________________________________________________ 。
【结论二】结论一中反应的ΔH________ (填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,_______________________ (请描述必要的实验操作和现象)。
资料:
ⅰ.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O
 [Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);ⅱ.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验Ⅰ】

【实验Ⅱ】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验Ⅰ中,试管②溶液褪色的原因是
(2)实验Ⅰ中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是
(3)由实验Ⅱ图甲、乙可知:加热时,溶液颜色
(4)由实验Ⅱ,可以得出如下结论:
【结论一】FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O
 [Fe(H2O)6]3++4Cl-得出此结论的理由是
[Fe(H2O)6]3++4Cl-得出此结论的理由是【结论二】结论一中反应的ΔH
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,
您最近一年使用:0次
2018-03-24更新
|
575次组卷
|
6卷引用:安徽省滁州市定远县重点中学2020-2021学年高二10月月考化学试题
名校
8 . 下列实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
| C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-04-19更新
|
556次组卷
|
7卷引用:安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题
名校
解题方法
9 . 下列实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3—被Fe2+还原为NO2 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
403次组卷
|
4卷引用:安徽省六安市第一中学2018届高三上学期第五次月考化学试题
名校
10 . Na2CO3水溶液中存在CO +H2O
+H2O HCO
HCO +OH-平衡。下列说法不正确的是
+OH-平衡。下列说法不正确的是
 +H2O
+H2O HCO
HCO +OH-平衡。下列说法不正确的是
+OH-平衡。下列说法不正确的是A.稀释溶液,  增大 增大 | B.通入CO2,溶液pH减小 |
| C.升高温度,此平衡常数增大 | D.加入NaOH固体,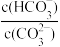 减小 减小 |
您最近一年使用:0次
2022-12-05更新
|
408次组卷
|
19卷引用:安徽省青阳县第一中学2019-2020学年高二11月月考化学试题
安徽省青阳县第一中学2019-2020学年高二11月月考化学试题2015届山东省桓台县第二中学高三1月检测化学试卷2016届山东省桓台第二中学高三上学期期中测试化学试卷(已下线)2018年11月1日 《每日一题》人教选修4-盐类水解的影响因素(已下线)2019年1月5日 《每日一题》人教选修4-周末培优【全国百强校】广西南宁市第三中学2018-2019学年高二下学期第一次月考化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高二上学期期中考试(2)化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 水解平衡常数的应用云南省昆明市东川区明月中学2018-2019学年高二下学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过模拟 2年模拟精编精练山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期期中考试化学试题江西省南昌县莲塘第一中学2022-2023学年高二上学期11月期中化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二上学期1月期末考试化学试题吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题



