1 . 根据实验目的,下列实验操作及现象与结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH, 后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 验证Cl2与H2O的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和淀粉-KI溶液,前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| C | 探究氢离子浓度对 (黄色)。 (黄色)。 (橙红色)相互转化的影响 (橙红色)相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大c(H+),转化平衡向生成 的方向移动 的方向移动 |
| D | 比较AgCl与AgI的溶度积大小 | 向2mL0.1 AgNO3溶液中先滴加4滴0.1 AgNO3溶液中先滴加4滴0.1 KCl溶液,再滴加4滴0.1 KCl溶液,再滴加4滴0.1 KI溶液,先产生白色沉淀,再产生黄色沉淀 KI溶液,先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,AgI的溶度积小于AgCl的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 下列试题中,溶液温度均为常温,请回答:
(1)0.1mol/L的醋酸钠溶液pH=10的原因是
(2)0.1mol/L的NaCN溶液中各离子浓度由大到小的顺序是
(3)浓度均为0.1mol·L-1的V1LHCl溶液和V2LNaOH溶液混合后,混合溶液的pH=12,则V1:V2=
(4)CH3COONa和CH3COOH的混合溶液中c(Na+)=c(CH3COO-),则该溶液呈
(5)在日常生活中经常用硫酸铝和碳酸氢钠混合溶液作灭火剂,请用离子方程式表示其灭火原理:
(6)物质的量浓度均为0.1mol·L-1的4种溶液:①NH3·H2O、②NH4HSO4、③CH3COONH4、④NH4Cl,按要求从大到小按序号排序,c(
 ):
):
您最近半年使用:0次
名校
3 . 在日常生产生活中,经常涉及化学反应原理,下列过程或现象与盐类水解无关的是
| A.加热氯化铁溶液,颜色变深 |
B. 与 与 溶液可用作焊接金属时的除锈剂 溶液可用作焊接金属时的除锈剂 |
| C.氯化钙溶液中滴加甲基橙,溶液显黄色 |
D.实验室中盛放 溶液的试剂瓶不能用磨口玻璃塞 溶液的试剂瓶不能用磨口玻璃塞 |
您最近半年使用:0次
2024-03-09更新
|
176次组卷
|
2卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
4 . 常温下,现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)上述溶液中,可发生水解的是________ (填序号,下同)。
(2)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________ 。
(3)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)____________ 。
(4)将③和④等体积混合后,混合液中各离子浓度关系正确的是 。
(5)取10mL溶液③,加水稀释到1L,则此时溶液中由水电离出的c(H+)=__________ 。
(1)上述溶液中,可发生水解的是
(2)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(3)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)
(4)将③和④等体积混合后,混合液中各离子浓度关系正确的是 。
A.c(Na+)=c(Cl﹣)>c(OH﹣)>c(NH ) ) |
| B.c(Na+)=0.1mol/L |
C.c(Na+)+c(NH )=c(Cl﹣)+c(OH﹣) )=c(Cl﹣)+c(OH﹣) |
| D.c(H+)>c(OH﹣) |
您最近半年使用:0次
名校
5 . FeCl3是中学化学常用试剂,在化学实验中有广泛应用。
(1)已知: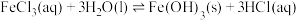 。配制一定浓度FeCl3溶液时,将FeCl3固体溶于浓盐酸中,加入蒸馏水稀释至指定浓度。盐酸的作用是
。配制一定浓度FeCl3溶液时,将FeCl3固体溶于浓盐酸中,加入蒸馏水稀释至指定浓度。盐酸的作用是___________ 。
(2)探究外界条件对双氧水分解速率的影响,设计如下实验(忽略溶液混合时的体积变化):
①实验Ⅱ中,V=___________ 。
②根据实验Ⅱ、Ⅲ中b>c不能确认 对双氧水分解催化效率小于
对双氧水分解催化效率小于 ,其原因是
,其原因是___________ 。
③为了探究温度对H2O2分解速率的影响,宜选择实验___________ (填序号)。
(3)向 溶液中滴加1滴KSCN溶液,将溶液分成甲、乙、丙、丁四份,进一步进行如下实验:
溶液中滴加1滴KSCN溶液,将溶液分成甲、乙、丙、丁四份,进一步进行如下实验:
①丙中不形成AgSCN沉淀,则丙中可观察到溶液颜色___________ (填“变深”“变浅”或“不变”)。
②甲的作用是___________ ;由丁中实验现象可得出的结论是___________ 。
(4)为探究FeCl3溶液和KI溶液反应,设计实验装置如图所示。

①实验Ⅳ中,电流表指针___________ (填“向左”“向右”或“不”)偏转。由此可推知,上述反应是可逆反应,其判断依据是___________ 。
②实验Ⅳ发生反应的离子方程式为___________ 。
(1)已知:
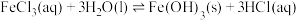 。配制一定浓度FeCl3溶液时,将FeCl3固体溶于浓盐酸中,加入蒸馏水稀释至指定浓度。盐酸的作用是
。配制一定浓度FeCl3溶液时,将FeCl3固体溶于浓盐酸中,加入蒸馏水稀释至指定浓度。盐酸的作用是(2)探究外界条件对双氧水分解速率的影响,设计如下实验(忽略溶液混合时的体积变化):
| 实验 | 30%双氧水/mL | 温度/℃ | 添加物质 | 加入蒸馏水/mL | 收集10mLO2用时/min |
| Ⅰ | 20 | 30 | 无 | 4 | a |
| Ⅱ | 20 | 30 | 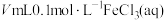 | 2 | b |
| Ⅲ | 20 | 30 |  | 2 | c |
| Ⅳ | 20 | 40 | 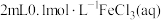 | 2 | d |
②根据实验Ⅱ、Ⅲ中b>c不能确认
 对双氧水分解催化效率小于
对双氧水分解催化效率小于 ,其原因是
,其原因是③为了探究温度对H2O2分解速率的影响,宜选择实验
(3)向
 溶液中滴加1滴KSCN溶液,将溶液分成甲、乙、丙、丁四份,进一步进行如下实验:
溶液中滴加1滴KSCN溶液,将溶液分成甲、乙、丙、丁四份,进一步进行如下实验:| 代号 | 加入少量物质 | 溶液颜色变化 |
| 甲 | 无 | 仍为红色 |
| 乙 | 1gNaOH(s) | 变浅 |
| 丙 | 1gAgNO3(s) | ? |
| 丁 | 1gFeCl3(s) | 变深 |
②甲的作用是
(4)为探究FeCl3溶液和KI溶液反应,设计实验装置如图所示。

| 步骤 | 操作及现象 | 测定数据 |
| Ⅰ | 向烧杯中加入如图所示试剂,左侧烧杯液体颜色变浅,右侧烧杯液体变为棕色,电流表指针向左偏转 | 测得电流强度为a(a>0) |
| Ⅱ | 随后,左侧烧杯液体变浅绿色,右侧烧杯液体棕色加深 | 测得电流强度为b(b<a) |
| Ⅲ | 一段时间后,指针回到零 | 测得电流强度为0 |
| Ⅳ | 在左侧烧杯中加入少量FeCl2(s),电流表指针偏转 | 测得电流强度为x |
②实验Ⅳ发生反应的离子方程式为
您最近半年使用:0次
2023-10-09更新
|
66次组卷
|
2卷引用:安徽省部分重点中学2023-2024学年高二上学期10月大联考化学试题
6 . 下列实验操作对应的现象及结论都正确,且二者之间有因果关系的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将CuCl2溶液由0.1mol•L-1稀释到0.01mol•L-1,测溶液pH | 溶液pH变小 | 稀释后,Cu2+的水解程度增大 |
| B | 将炽热的黑色铜丝迅速伸入盛有待测试剂的试管中 | 铜丝变为亮红色 | 试剂中存在醛基 |
| C | 向Ba(OH)2溶液中滴加少量稀硫酸,测量电导率变化 | 电导率减小 | 溶液中的离子浓度减小 |
| D | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 | 生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7 . 稀土元素是国家战略资源,广泛应用于显示器、航天、激光。导弹等尖端领域,目前我国稀土提炼技术处于世界领先地位。某化学课题组以废液晶显示屏为原料回收稀土元素铈,实现资源再利用,设计实验流程如下:
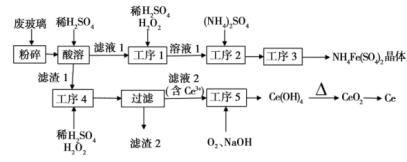
已知:①显示屏玻璃中含较多的SiO2、CeO2、FeO、Fe2O3及少量其他可溶于酸的物质;
②CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)将废玻璃粉碎的目的是___________ 。
(2)工序1中加入H2O2的作用是___________ 。
(3)工序3是蒸发浓缩、___________ 、过滤、洗涤、常温晾干。
(4)工序4中加入稀硫酸和H2O2溶液的反应的离子方程式___________ ,滤渣2的主要成分是___________ 。
(5)硫酸铁铵可用作净水剂,但在除酸性废水中悬浮物时效果较差,原因是___________ 。
(6)取上述流程中得到Ce(OH)4产品0.640g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该产品中Ce元素的质量分数为___________ ,(保留三位有效数字)

已知:①显示屏玻璃中含较多的SiO2、CeO2、FeO、Fe2O3及少量其他可溶于酸的物质;
②CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)将废玻璃粉碎的目的是
(2)工序1中加入H2O2的作用是
(3)工序3是蒸发浓缩、
(4)工序4中加入稀硫酸和H2O2溶液的反应的离子方程式
(5)硫酸铁铵可用作净水剂,但在除酸性废水中悬浮物时效果较差,原因是
(6)取上述流程中得到Ce(OH)4产品0.640g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该产品中Ce元素的质量分数为
您最近半年使用:0次
名校
8 . 浓度均为0.1mol/L的NH4Cl、(NH4)2SO4、NH4HSO4、(NH4)2Fe(SO4)2四种溶液中,设NH 离子浓度分别为amol/L、bmol/L和cmol/L,dmol/L则a、b、c、d关系为
离子浓度分别为amol/L、bmol/L和cmol/L,dmol/L则a、b、c、d关系为
 离子浓度分别为amol/L、bmol/L和cmol/L,dmol/L则a、b、c、d关系为
离子浓度分别为amol/L、bmol/L和cmol/L,dmol/L则a、b、c、d关系为| A.b=d>a=c | B.c<a<b<d | C.a<c<b=d | D.a<c<b<d |
您最近半年使用:0次
2023-05-11更新
|
468次组卷
|
2卷引用:安徽省六安市裕安区新安中学2022-2023学年高二下学期期中考试化学试题
9 . 实验室可使用Mg(OH)2为原料制备无水MgCl2实验过程如下:
I.在烧杯中将Mg(OH)2粉末与足量无水乙醇充分混合,搅拌混合均匀后装入三颈烧瓶。
II.向三颈烧瓶中通入足量HCl气体使Mg(OH)2固体完全溶解。
III.对反应后的溶液进行加热蒸馏,形成CH3CH2OH•6MgCl2溶液。
IV.对CH3CH2OH•6MgCl2溶液进行进一步脱乙醇蒸馏,得到较为纯净的无水MgCl2。
回答下列问题:
(1)步骤I中选择乙醇而非相对分子质量更大的丁醇的原因是______ 。
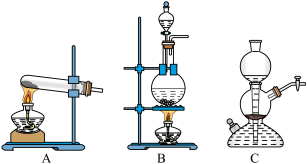
(2)步骤II中的HCl气体可由下列装置中的______ (填标号)制备。装置B中玻璃仪器的名称分别是导管、酒精灯、______ 、______ 。
(3)CH3CH2OH•6MgCl2在加热蒸馏时可能会发生分解产生少量CH4气体,并伴随MgO和碳单质的生成,该分解反应的化学方程式为______ 。为提高无水氯化镁的产率,从平衡角度分析抑制该副反应的措施是______ 。
(4)准确称量制得的无水MgCl2产品9.700g(含有少量MgO杂质),将其完全溶于稀盐酸中,加入过量Na2CO3溶液使Mg2+完全转化为MgCO3沉淀,过滤、洗涤、干燥,称量所得固体质量为8.820g。
①检验固体洗涤完成的方法是______ 。
②产品中MgCl2的纯度为______ %(计算结果保留一位小数)。
I.在烧杯中将Mg(OH)2粉末与足量无水乙醇充分混合,搅拌混合均匀后装入三颈烧瓶。
II.向三颈烧瓶中通入足量HCl气体使Mg(OH)2固体完全溶解。
III.对反应后的溶液进行加热蒸馏,形成CH3CH2OH•6MgCl2溶液。
IV.对CH3CH2OH•6MgCl2溶液进行进一步脱乙醇蒸馏,得到较为纯净的无水MgCl2。
回答下列问题:
(1)步骤I中选择乙醇而非相对分子质量更大的丁醇的原因是
(2)步骤II中的HCl气体可由下列装置中的

(3)CH3CH2OH•6MgCl2在加热蒸馏时可能会发生分解产生少量CH4气体,并伴随MgO和碳单质的生成,该分解反应的化学方程式为
(4)准确称量制得的无水MgCl2产品9.700g(含有少量MgO杂质),将其完全溶于稀盐酸中,加入过量Na2CO3溶液使Mg2+完全转化为MgCO3沉淀,过滤、洗涤、干燥,称量所得固体质量为8.820g。
①检验固体洗涤完成的方法是
②产品中MgCl2的纯度为
您最近半年使用:0次
名校
10 . 一定条件下,醋酸钠(用NaAc表示)稀溶液中存在平衡: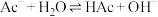 ,其平衡常数为
,其平衡常数为 。下列说法正确的是
。下列说法正确的是
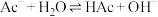 ,其平衡常数为
,其平衡常数为 。下列说法正确的是
。下列说法正确的是A.升高温度,平衡正向移动, 增大 增大 |
B.通入少量 ,平衡逆向移动, ,平衡逆向移动, 减小 减小 |
| C.通入少量HCl,平衡正向移动,溶液pH增大 |
D.加入少量冰醋酸,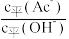 减小 减小 |
您最近半年使用:0次
2023-03-11更新
|
286次组卷
|
3卷引用:安徽省亳州市普通高中2022-2023学年高二上学期期末考试化学试题
安徽省亳州市普通高中2022-2023学年高二上学期期末考试化学试题四川省雅安中学2022-2023学年高二下学期3月月考化学试题(已下线)第13讲 盐类的水解-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)



