名校
1 . 下列说法正确的是
A.向0.1 mol•L−1的氨水中加少量硫酸铵固体,则溶液中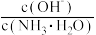 增大 增大 |
| B.常温下,0.1 mol·L−1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A−)+KW |
C.向盐酸中加入氨水至中性,溶液中 |
| D.将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质 |
您最近一年使用:0次
名校
2 . 有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaA、NaB、NaC,以下说法中不正确的是
| A.在三种酸HA、HB、HC中以HC酸性相对最弱 |
| B.中和1mol三种酸,需要的NaOH均为1mol |
| C.在A-、B-、C-三者中,A-结合H+的能力最强 |
| D.HA、HB、HC三者均为弱酸 |
您最近一年使用:0次
2020-10-15更新
|
282次组卷
|
3卷引用:安徽省阜阳市太和第一中学2020-2021学年高二上学期10月月考化学试题
名校
3 . 实验测定 溶液显碱性,下列说法中正确的是
溶液显碱性,下列说法中正确的是
 溶液显碱性,下列说法中正确的是
溶液显碱性,下列说法中正确的是A.在水溶液中, 仅发生水解 仅发生水解 |
B.在水溶液中, 仅发生电离 仅发生电离 |
C.在水溶液中, 的电离程度要大于水解程度 的电离程度要大于水解程度 |
D.在水溶液中, 的水解程度要大于电离程度 的水解程度要大于电离程度 |
您最近一年使用:0次
2020-09-14更新
|
746次组卷
|
6卷引用:安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题
名校
4 . 25℃时,0.1mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的___ (填写编号),然后测定溶液的pH(已知25℃时CH3COONH4溶液呈中性)。
A. 固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若___ (填“甲”或“乙”)的解释正确,溶液的pH应___ (填“增大”“减小”或“不变”)。
(3)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。其中有两种粒子的物质的量之和一定等于0.01mol,它们是__ 和___ (用离子式和分子式表示)。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的
A. 固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若
(3)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。其中有两种粒子的物质的量之和一定等于0.01mol,它们是
您最近一年使用:0次
5 . 关于0.1 mol/L醋酸钠溶液,下列说法正确的是
A.加少量水稀释时, 增大 增大 |
| B.向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大 |
| C.离子浓度大小比较:c(CH3COO-) >c(Na+) >c(OH-) > c(H+) |
| D.向其中加入盐酸至恰好呈中性时,c(Na+) = c(CH3COO-) |
您最近一年使用:0次
2018-01-06更新
|
713次组卷
|
2卷引用:安徽省太和第一中学2019-2020学年高二上学期第一次月考(飞越班)化学试题
名校
6 . 在一定条件下,Na2S溶液存在水解平衡:S2-+H2O HS- +OH-,下列说法正确的是
HS- +OH-,下列说法正确的是
 HS- +OH-,下列说法正确的是
HS- +OH-,下列说法正确的是| A.稀释溶液,水解平衡常数增大 | B.升高温度,c(HS-)/c(S2- )增大 |
| C.加入NaOH固体,溶液pH减小 | D.加入CuSO4固体,HS-浓度增大 |
您最近一年使用:0次
2017-12-17更新
|
390次组卷
|
5卷引用:安徽省阜阳市第三中学2018-2019学年高二下学期开学考试化学试题
2014·福建厦门·一模
名校
7 . 下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| D.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
您最近一年使用:0次
2016-12-09更新
|
920次组卷
|
4卷引用:安徽省太和第一中学2019-2020学年高二上学期第一次月考(飞越班)化学试题
安徽省太和第一中学2019-2020学年高二上学期第一次月考(飞越班)化学试题(已下线)2013-2014福建厦门双十中学高中毕业班测试七化学试卷广东省珠海市2020-2021学年高二上学期期末考试化学试题安徽省宿州市泗县第一中学2023-2024学年高二下学期开学考试化学试题



