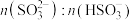1 . 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_______ 。(单项)
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.铵根离子浓度增大,抑制了氨水的电离,使c(OH-)减小
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.铵根离子浓度增大,抑制了氨水的电离,使c(OH-)减小
您最近半年使用:0次
名校
2 . 已知 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
1.物质的量浓度均为 的下列四种溶液:
的下列四种溶液: 最大是___________。
最大是___________。
2.标准状况下将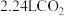 ,通入
,通入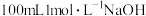 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
___________ 。
 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 |  |  |  |
| 电离平衡常数 |  | 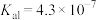  |  |
 的下列四种溶液:
的下列四种溶液: 最大是___________。
最大是___________。A. | B. | C. | D. |
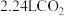 ,通入
,通入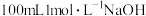 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
您最近半年使用:0次
名校
3 . 25℃时部分弱酸的电离平衡常数如下表:
1.室温下① ②
② ③
③ ④
④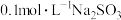 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)_____ 。
2.下列离子方程式书写正确的是
| 弱酸 |  |  |  |  |
| 电离平衡常数 |  | 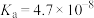 |   | 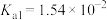  |
 ②
② ③
③ ④
④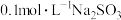 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)2.下列离子方程式书写正确的是
A.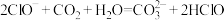 |
B. |
C. |
D. |
您最近半年使用:0次
名校
4 . 常温下 下列物质的水溶液,加热到
下列物质的水溶液,加热到 ,溶液
,溶液 几乎不变的是
几乎不变的是
 下列物质的水溶液,加热到
下列物质的水溶液,加热到 ,溶液
,溶液 几乎不变的是
几乎不变的是| A.氢氧化钾 | B.硫酸铵 | C.盐酸 | D.硫酸 |
您最近半年使用:0次
名校
5 . 醋酸钠是一种常用的防腐剂和缓冲剂。某小组探究外界因素对 水解程度的影响。
水解程度的影响。
(1)写出 水解的离子方程式
水解的离子方程式___________ 。
(2)甲同学设计实验方案如下(表中溶解浓度均为 )。
)。
i.实验___________ (填序号),探究加水稀释对 水解程度的影响。
水解程度的影响。
ii.实验1和3,探究加入 对
对 水解程度的影响。
水解程度的影响。
iii.实验1和4,探究温度对 水解程度的影响,
水解程度的影响, 。
。
(3)根据甲同学的实验方案,补充数据:
___________ 。实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据___________ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
(4) 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测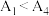 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是___________ 。
 水解程度的影响。
水解程度的影响。(1)写出
 水解的离子方程式
水解的离子方程式(2)甲同学设计实验方案如下(表中溶解浓度均为
 )。
)。i.实验
 水解程度的影响。
水解程度的影响。ii.实验1和3,探究加入
 对
对 水解程度的影响。
水解程度的影响。iii.实验1和4,探究温度对
 水解程度的影响,
水解程度的影响, 。
。| 序号 | 温度 |  |  | 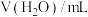 |  |
| 1 |  | 40.0 | 0 | 0 |  |
| 2 |  | 4.0 | 0 | 36.0 |  |
| 3 |  | 20.0 | 10.0 | a |  |
| 4 |  | 40.0 | 0 | 0 | 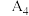 |

 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。(4)
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测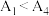 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是
您最近半年使用:0次
名校
解题方法
6 . 10℃时加热 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:
对于上述实验过程中的现象,甲同学和乙同学的观点如下:
(1)甲同学认为,最终该溶液的pH升高的原因是 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为______________________________ 。
(2)乙同学认为最终溶液pH升高的原因是 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为______________________________ ,并判断 的水解程度
的水解程度__________ (选填“>”或“<”) 。
。
关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________ (选填“甲”或“乙”)判断正确。试剂X是__________ 。
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
___________________________________________________________
(5) 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:
表中第__________ 组(选填序号)数据,可判断 溶液显
溶液显__________ (选填“酸”或“碱”)性。
 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,最终该溶液的pH升高的原因是
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为(2)乙同学认为最终溶液pH升高的原因是
 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为 的水解程度
的水解程度 。
。关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
(5)
 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:9 |
pH | 8.2 | 7.2 | 6.2 |
 溶液显
溶液显
您最近半年使用:0次
名校
解题方法
7 . 漂白粉在溶液中存在平衡: ,下列措施能增强漂白能力是
,下列措施能增强漂白能力是
 ,下列措施能增强漂白能力是
,下列措施能增强漂白能力是A.加 稀释 稀释 | B.加少量纯碱 | C.通入 | D.滴加适量食醋 |
您最近半年使用:0次
名校
8 . 现代洗涤液问世前,纯碱(Na2CO3)常用来洗涤油性物质,以下是纯碱水解的化学方程式:Na2CO3+H2O NaHCO3+NaOH(吸热反应),纯碱水解后呈碱性,能除去油污,以下措施中能提高纯碱的去污能力的是
NaHCO3+NaOH(吸热反应),纯碱水解后呈碱性,能除去油污,以下措施中能提高纯碱的去污能力的是
 NaHCO3+NaOH(吸热反应),纯碱水解后呈碱性,能除去油污,以下措施中能提高纯碱的去污能力的是
NaHCO3+NaOH(吸热反应),纯碱水解后呈碱性,能除去油污,以下措施中能提高纯碱的去污能力的是| A.用热水 | B.用冷水 | C.加小苏打(NaHCO3) | D.加入大量的水 |
您最近半年使用:0次
名校
解题方法
9 . I.含铜电路板可以用FeCl3溶液进行刻蚀,对刻蚀后的液体(主要含FeCl3、FeCl2、CuCl2等)进行处理,可以回收FeCl2·4H2O和CuSO4·5H2O,工艺流程如下:
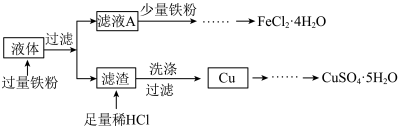
(1)从滤液A中提取FeCl2·4H2O的操作为:加入少量铁粉后,先浓缩滤液至出现___________ ,趁热过滤,取溶液,___________ ,过滤、洗涤、干燥;浓缩滤液前先加入少量铁粉的原因是___________ 。
(2)检验从滤渣中提取出的Cu上Cl—已洗净的操作为:___________ ;制备CuSO4·5H2O时,将Cu溶解于H2SO4、HNO3的混酸中,若该过程中产生的气体只有NO,且反应后溶质只有CuSO4,则混酸中H2SO4、HNO3的浓度之比为___________ 。
II.利用滴定法可以测定CuSO4·5H2O的纯度,操作如下:
①取agCuSO4·5H2O样品,加入足量NH4F—HF混合溶液溶解 (其中F—防止Fe3+干扰检验:Fe3++6F—=[FeF6]3—)。
②滴加足量KI溶液,发生反应:2Cu2++4I—=2CuI↓+I2。
③用cmol·L-1Na2S2O3标准溶液滴定,以淀粉溶液为指示剂,到达滴定终点时消耗Na2S2O3标准液VmL,发生的反应为:I2+2 =
= +2I—。
+2I—。
(3)已知NH4F溶液呈酸性,则水解程度:
___________ F—(选填“>”“<”或“=”),加水稀释,溶液中
___________ (选填“变大”“变小”或“不变”)。
(4)已知CuI沉淀能够大量吸附I2,因此在接近滴定终点时向溶液中滴加KSCN溶液,CuI转化为CuSCN,通过平衡移动的原理解释沉淀转化的原因:___________ 。
(5)CuSO4·5H2O的质量分数为___________ (用含a,c,V的代数式表示)。若步骤①使用蒸馏水溶解样品,则测得CuSO4·5H2O的质量分数将___________ ;若步骤③不滴加KSCN溶液,则测得CuSO4·5H2O的质量分数将___________ (均选填“偏高”“偏低”或“不变”)。

(1)从滤液A中提取FeCl2·4H2O的操作为:加入少量铁粉后,先浓缩滤液至出现
(2)检验从滤渣中提取出的Cu上Cl—已洗净的操作为:
II.利用滴定法可以测定CuSO4·5H2O的纯度,操作如下:
①取agCuSO4·5H2O样品,加入足量NH4F—HF混合溶液溶解 (其中F—防止Fe3+干扰检验:Fe3++6F—=[FeF6]3—)。
②滴加足量KI溶液,发生反应:2Cu2++4I—=2CuI↓+I2。
③用cmol·L-1Na2S2O3标准溶液滴定,以淀粉溶液为指示剂,到达滴定终点时消耗Na2S2O3标准液VmL,发生的反应为:I2+2
 =
= +2I—。
+2I—。(3)已知NH4F溶液呈酸性,则水解程度:


(4)已知CuI沉淀能够大量吸附I2,因此在接近滴定终点时向溶液中滴加KSCN溶液,CuI转化为CuSCN,通过平衡移动的原理解释沉淀转化的原因:
(5)CuSO4·5H2O的质量分数为
您最近半年使用:0次
名校
10 . 25℃时部分弱酸的电离平衡常数如下表:
(1)室温下① ,②
,② ③
③ ,溶液的pH由大到小的关系为
,溶液的pH由大到小的关系为___________ 。
(2)草木灰的主要成分是 ,使用时不能与铵态氮肥混合使用,原因是
,使用时不能与铵态氮肥混合使用,原因是___________ 。
(3)下列离子方程式书写正确的是___________ 。(填字母)。
a.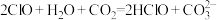
b.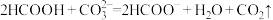
c.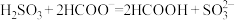
d.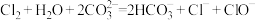
(4)泡沫灭火器的主要成分是硫酸铝溶液和碳酸氢钠溶液,这两种溶液混合后,反应的离子方程式为___________ 。
(5)某二元酸(化学式用 表示)在水中的电离方程式是
表示)在水中的电离方程式是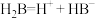 ,
, 。已知
。已知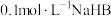 溶液pH=2,则
溶液pH=2,则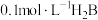 溶液中氢离子的物质的量浓度可能
溶液中氢离子的物质的量浓度可能___________ (填“>”“<”或“=”) ,理由是
,理由是___________ 。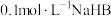 溶液中各种离子浓度由大到小的顺序是
溶液中各种离子浓度由大到小的顺序是___________ 。
| 弱酸 | HCOOH | HClO |  |  |
| 电离平衡常数 |  | 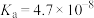 |   | 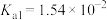  |
 ,②
,② ③
③ ,溶液的pH由大到小的关系为
,溶液的pH由大到小的关系为(2)草木灰的主要成分是
 ,使用时不能与铵态氮肥混合使用,原因是
,使用时不能与铵态氮肥混合使用,原因是(3)下列离子方程式书写正确的是
a.
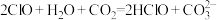
b.
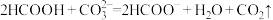
c.
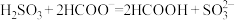
d.
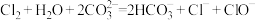
(4)泡沫灭火器的主要成分是硫酸铝溶液和碳酸氢钠溶液,这两种溶液混合后,反应的离子方程式为
(5)某二元酸(化学式用
 表示)在水中的电离方程式是
表示)在水中的电离方程式是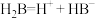 ,
, 。已知
。已知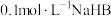 溶液pH=2,则
溶液pH=2,则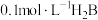 溶液中氢离子的物质的量浓度可能
溶液中氢离子的物质的量浓度可能 ,理由是
,理由是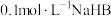 溶液中各种离子浓度由大到小的顺序是
溶液中各种离子浓度由大到小的顺序是
您最近半年使用:0次