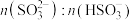名校
解题方法
1 . 10℃时加热 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:
对于上述实验过程中的现象,甲同学和乙同学的观点如下:
(1)甲同学认为,最终该溶液的pH升高的原因是 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为______________________________ 。
(2)乙同学认为最终溶液pH升高的原因是 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为______________________________ ,并判断 的水解程度
的水解程度__________ (选填“>”或“<”) 。
。
关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________ (选填“甲”或“乙”)判断正确。试剂X是__________ 。
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
___________________________________________________________
(5) 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:
表中第__________ 组(选填序号)数据,可判断 溶液显
溶液显__________ (选填“酸”或“碱”)性。
 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,最终该溶液的pH升高的原因是
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为(2)乙同学认为最终溶液pH升高的原因是
 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为 的水解程度
的水解程度 。
。关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
(5)
 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:9 |
pH | 8.2 | 7.2 | 6.2 |
 溶液显
溶液显
您最近一年使用:0次
名校
解题方法
2 . I.含铜电路板可以用FeCl3溶液进行刻蚀,对刻蚀后的液体(主要含FeCl3、FeCl2、CuCl2等)进行处理,可以回收FeCl2·4H2O和CuSO4·5H2O,工艺流程如下:
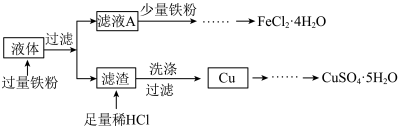
(1)从滤液A中提取FeCl2·4H2O的操作为:加入少量铁粉后,先浓缩滤液至出现___________ ,趁热过滤,取溶液,___________ ,过滤、洗涤、干燥;浓缩滤液前先加入少量铁粉的原因是___________ 。
(2)检验从滤渣中提取出的Cu上Cl—已洗净的操作为:___________ ;制备CuSO4·5H2O时,将Cu溶解于H2SO4、HNO3的混酸中,若该过程中产生的气体只有NO,且反应后溶质只有CuSO4,则混酸中H2SO4、HNO3的浓度之比为___________ 。
II.利用滴定法可以测定CuSO4·5H2O的纯度,操作如下:
①取agCuSO4·5H2O样品,加入足量NH4F—HF混合溶液溶解 (其中F—防止Fe3+干扰检验:Fe3++6F—=[FeF6]3—)。
②滴加足量KI溶液,发生反应:2Cu2++4I—=2CuI↓+I2。
③用cmol·L-1Na2S2O3标准溶液滴定,以淀粉溶液为指示剂,到达滴定终点时消耗Na2S2O3标准液VmL,发生的反应为:I2+2 =
= +2I—。
+2I—。
(3)已知NH4F溶液呈酸性,则水解程度:
___________ F—(选填“>”“<”或“=”),加水稀释,溶液中
___________ (选填“变大”“变小”或“不变”)。
(4)已知CuI沉淀能够大量吸附I2,因此在接近滴定终点时向溶液中滴加KSCN溶液,CuI转化为CuSCN,通过平衡移动的原理解释沉淀转化的原因:___________ 。
(5)CuSO4·5H2O的质量分数为___________ (用含a,c,V的代数式表示)。若步骤①使用蒸馏水溶解样品,则测得CuSO4·5H2O的质量分数将___________ ;若步骤③不滴加KSCN溶液,则测得CuSO4·5H2O的质量分数将___________ (均选填“偏高”“偏低”或“不变”)。

(1)从滤液A中提取FeCl2·4H2O的操作为:加入少量铁粉后,先浓缩滤液至出现
(2)检验从滤渣中提取出的Cu上Cl—已洗净的操作为:
II.利用滴定法可以测定CuSO4·5H2O的纯度,操作如下:
①取agCuSO4·5H2O样品,加入足量NH4F—HF混合溶液溶解 (其中F—防止Fe3+干扰检验:Fe3++6F—=[FeF6]3—)。
②滴加足量KI溶液,发生反应:2Cu2++4I—=2CuI↓+I2。
③用cmol·L-1Na2S2O3标准溶液滴定,以淀粉溶液为指示剂,到达滴定终点时消耗Na2S2O3标准液VmL,发生的反应为:I2+2
 =
= +2I—。
+2I—。(3)已知NH4F溶液呈酸性,则水解程度:


(4)已知CuI沉淀能够大量吸附I2,因此在接近滴定终点时向溶液中滴加KSCN溶液,CuI转化为CuSCN,通过平衡移动的原理解释沉淀转化的原因:
(5)CuSO4·5H2O的质量分数为
您最近一年使用:0次
名校
3 . Ⅰ.某浓度碳酸钠溶液的pH随温度的变化如下左图所示,室温下碳酸钠溶液的pH随浓度的变化如下右图所示。

完成下列问题:
(1)用离子方程式表示Na2CO3溶液呈碱性的主要原因:___________ 。
(2)下列判断正确的是___________。
Ⅱ.向0.6 mol∙L−1的Na2CO3溶液中滴加盐酸至Na2CO3浓度约为0.5 mol∙L−1。
(3)根据上右图判断,所得溶液的pH___________ 12.0 (填“>”、“<”或“=”) 。
(4)关于所得溶液中离子浓度关系判断正确的是___________。
(5)将上述溶液与足量盐酸反应后的CO2通入Na2SiO3溶液,溶液变浑浊。该现象___________ (填“能”或“不能”)说明酸性H2CO3>H2SiO3。若能,说明理由,若不能,说明实验的改进方案。___________ 。

完成下列问题:
(1)用离子方程式表示Na2CO3溶液呈碱性的主要原因:
(2)下列判断正确的是___________。
| A.a点Na2CO3的水解程度最小 |
| B.b点水的电离程度最大 |
C.c点溶液中的 约为 约为 |
| D.根据上右图推断,上左图中溶液的浓度约为0.3 mol∙L−1 |
Ⅱ.向0.6 mol∙L−1的Na2CO3溶液中滴加盐酸至Na2CO3浓度约为0.5 mol∙L−1。
(3)根据上右图判断,所得溶液的pH
(4)关于所得溶液中离子浓度关系判断正确的是___________。
A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
解题方法
4 . 氮气与氢气反应生成氨气的平衡常数见下表:
(1)工业上合成氨的温度一般控制在500℃,原因是___________ 。
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为___________ mol/(L·min)。
(3)下列说法能表明该反应达到平衡的是___________。
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是___________。
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是___________。
(6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH )与c(Cl-)比值变大的是___________。
)与c(Cl-)比值变大的是___________。
N2+3H2 2NH3 2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为
(3)下列说法能表明该反应达到平衡的是___________。
| A.气体的平均分子量不再变化 | B.密闭容器内的压强不再变化 |
| C.v(N2)=2v(NH3) | D.气体的密度不再变化 |
| A.使用催化剂 | B.缩小容器体积 | C.提高反应温度 | D.移走NH3 |
| A.溶液的pH增大 | B.氨水的电离度减小 | C.c(OH-)减小 | D.c(NH )减小 )减小 |
 )与c(Cl-)比值变大的是___________。
)与c(Cl-)比值变大的是___________。| A.加入固体氯化铵 | B.通入少量氯化氢 |
| C.降低溶液温度 | D.加入少量固体氢氧化钠 |
您最近一年使用:0次
名校
解题方法
5 . 将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
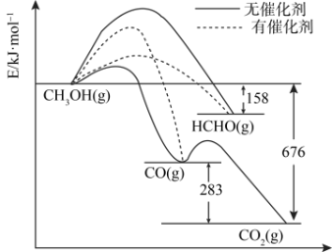
(1)在有催化剂作用下,CH3OH与O2反应主要生成___________ (填“CO”、“CO2”或HCHO”)。请补全热化学方程式HCHO(g)+1/2O2(g)=CO(g)+H2O(g)___________ 。
(2)请从有效碰撞理论的角度说明加入催化剂可以加快化学反应速率的原因:___________ 。
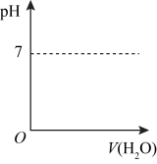
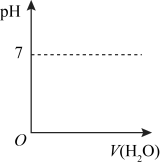
(3)HCHO可进一步被氧化为重要工业原料HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化___________ 。

(1)在有催化剂作用下,CH3OH与O2反应主要生成
(2)请从有效碰撞理论的角度说明加入催化剂可以加快化学反应速率的原因:
(3)HCHO可进一步被氧化为重要工业原料HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化

您最近一年使用:0次
6 . 冰壶比赛称为“冰上的国际象棋”,制作冰壶用的标准砥石的化学成分为石英碱长正长岩,常见的组分有钾长石K[AlSi3O8]和钠长石Na[AlSi3O8]等。完成下列填空:
(1)上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是_______ ,原子核外有两个未成对电子的元素有_______ 。
(2)用一个化学方程式比较钠和铝的金属性的强弱_______ ,并用原子结构知识的观点解释原因_______ 。
(3)我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式_______ 。
______Al+_______K[AlSi3O8]+_______AlCl3→_______Si+_______AlOCl+_______KAlO2;
上述反应中若产生14g硅,转移的电子数为_______ 。
(4)KAlO2溶液中,n(K+)_______ n(AlO )(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因_______ 。
(1)上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是
(2)用一个化学方程式比较钠和铝的金属性的强弱
(3)我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式
______Al+_______K[AlSi3O8]+_______AlCl3→_______Si+_______AlOCl+_______KAlO2;
上述反应中若产生14g硅,转移的电子数为
(4)KAlO2溶液中,n(K+)
 )(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
您最近一年使用:0次
解题方法
7 . I.联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)在25℃时,1.00gN2H4(l)与足量N2O4(1)完全反应生成N2(g)和H2O(1),放出19.14kJ的热量。写出该反应的热化学方程式_______ 。
II.NO2是氮的常见氧化物,能自发发生如下反应:2NO2(g)⇌N2O4(g) =-57.20kJ/mol
=-57.20kJ/mol
(2)写出该反应的平衡常数表达式K=_______ 。已知:在一定温度下的密闭容器中,该反应已达到平衡。保持其他条件不变,下列措施能提高NO2转化率的是_______ 。
a.减小NO2的浓度 b.降低温度 c.增大压强 d.升高温度
III.Na2CO3俗称纯碱,是生活中的常用物质。某化学兴趣小组的同学对Na2CO3溶液显碱性的原因进行了探究,设计了如下实验方案进行操作并记录实验现象。
(3)①该实验表明,Na2CO3溶液显碱性的原因是_______ (请结合化学用语,简要说明)。
②从形成盐的酸和碱的强弱角度看,Na2CO3属于_______ 盐。
③为了使Na2CO3溶液中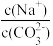 的比值变小,可适量加入(或通入)的物质是
的比值变小,可适量加入(或通入)的物质是_______ 。
a.CO2气体 b.KOH固体 c.HCl气体 d.Na2CO3固体
(1)在25℃时,1.00gN2H4(l)与足量N2O4(1)完全反应生成N2(g)和H2O(1),放出19.14kJ的热量。写出该反应的热化学方程式
II.NO2是氮的常见氧化物,能自发发生如下反应:2NO2(g)⇌N2O4(g)
 =-57.20kJ/mol
=-57.20kJ/mol(2)写出该反应的平衡常数表达式K=
a.减小NO2的浓度 b.降低温度 c.增大压强 d.升高温度
III.Na2CO3俗称纯碱,是生活中的常用物质。某化学兴趣小组的同学对Na2CO3溶液显碱性的原因进行了探究,设计了如下实验方案进行操作并记录实验现象。
| 实验操作 | 实验现象 |
| 取少量Na2CO3固体,加入无水酒精,充分振荡、静置 | 溶液为无色 |
| 取上层清液于试管中,滴加酚酞试剂 | 溶液为无色 |
| 在试管中继续加入少量水 | 溶液变为红色 |
| 向该红色溶液中滴加足量BaCl2溶液(中性) | 红色褪去 |
②从形成盐的酸和碱的强弱角度看,Na2CO3属于
③为了使Na2CO3溶液中
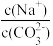 的比值变小,可适量加入(或通入)的物质是
的比值变小,可适量加入(或通入)的物质是a.CO2气体 b.KOH固体 c.HCl气体 d.Na2CO3固体
您最近一年使用:0次
2022-04-28更新
|
228次组卷
|
2卷引用:上海市宝山区2021-2022学年高三年级下学期等级考测化学试题
解题方法
8 . 化学社团小组的同学在测试Na2SO3溶液的pH时,遇到了困惑。为此,决心重新实验,揭开奥秘。请你也参与交流讨论。
a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论
(1)实验操作①所得溶液的物质的量浓度为___________ ;实验操作②中除酒精灯、玻璃棒、三角架及隔绝空气的设备外,还需要的仪器有___________ 。
(2)给Na2SO3•7H2O加热时为何要隔绝空气,请以简要的文字给以说明。___________
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是___________ 。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是(简要的文字和离子方程式给以说明)__________ 。
(5)请你设计简单的实验方案,给上述分析猜想及解释加以佐证。并简单叙述实验步骤、现象和结论。________ 。
a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论
(1)实验操作①所得溶液的物质的量浓度为
(2)给Na2SO3•7H2O加热时为何要隔绝空气,请以简要的文字给以说明。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是(简要的文字和离子方程式给以说明)
(5)请你设计简单的实验方案,给上述分析猜想及解释加以佐证。并简单叙述实验步骤、现象和结论。
您最近一年使用:0次
9 . 煤炭是我国最主要能源。煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K= ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:___________ ,若该反应只有在持续高温下才能自发进行 则该反应为___________ (“吸热”或“放热”)反应。
(2) 将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:
①实验1中以v(CO2)表示的反应速率为___________ 。
②900 ℃时,反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数
CO2(g)+H2(g)的平衡常数___________ 。向实验2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,平衡___________ (选填“正反应方向”、“逆反应方向”或“不”)移动。
(3)将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
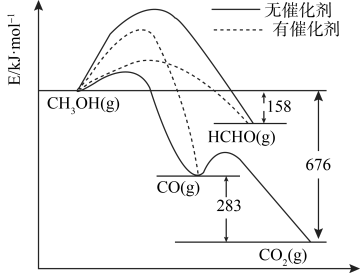
①在有催化剂作用下,CH3OH与O2反应主要生成___________ (填“CO”、“CO2”或HCHO”)。请补全热化学方程式HCHO(g)+1/2O2(g)→CO(g)+H2O(g)___________ 。
②HCHO可进一步被氧化为重要工业原料 HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化__________ 。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=
 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:(2) 将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
②900 ℃时,反应CO(g)+H2O(g)
 CO2(g)+H2(g)的平衡常数
CO2(g)+H2(g)的平衡常数(3)将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。

①在有催化剂作用下,CH3OH与O2反应主要生成
②HCHO可进一步被氧化为重要工业原料 HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化

您最近一年使用:0次
名校
10 . 氮化铝(AlN)是原子晶体。在室温下,具有强度高、导热性好的特点,是良好的耐热冲击材料。在800~1000℃下,铝粉可与氮气直接化合生成氮化铝。
(1)Al很活泼,但与N2反应需要高温条件,请用结构知识说明原因___________________ 。
(2)室温下,AlN在水中缓慢反生复分解反应,生成白色沉淀。写出上述反应的化学方程式_________________ ,反应后所得溶液呈碱性,其原因是____________________ 。反应后所得溶液加热到90℃时,溶液pH减小,请用化学平衡原理说明理由___________________ 。
(3)相同浓度的铝铵钒(NH4Al(SO4)2·12H2O)溶液与NH4Cl溶液,其中[ ]前者
]前者____________ 后者(选填“>”、“=”或“<”)。
(4)向一定量NH4Cl溶液中滴加NaOH溶液至溶液呈中性,则错误的推断是_____________________ 。
a.[Na+]=[NH3·H2O] b.[ ]+[Na+]>[Cl-] c.[
]+[Na+]>[Cl-] c.[ ]+[NH3·H2O]=[Cl-]
]+[NH3·H2O]=[Cl-]
(5)向含0.04molNH4HSO4的溶液中,逐滴加入100mL0.2mol·L-1Ba(OH)2,此反应的离子方程式为___ 。
(1)Al很活泼,但与N2反应需要高温条件,请用结构知识说明原因
(2)室温下,AlN在水中缓慢反生复分解反应,生成白色沉淀。写出上述反应的化学方程式
(3)相同浓度的铝铵钒(NH4Al(SO4)2·12H2O)溶液与NH4Cl溶液,其中[
 ]前者
]前者(4)向一定量NH4Cl溶液中滴加NaOH溶液至溶液呈中性,则错误的推断是
a.[Na+]=[NH3·H2O] b.[
 ]+[Na+]>[Cl-] c.[
]+[Na+]>[Cl-] c.[ ]+[NH3·H2O]=[Cl-]
]+[NH3·H2O]=[Cl-](5)向含0.04molNH4HSO4的溶液中,逐滴加入100mL0.2mol·L-1Ba(OH)2,此反应的离子方程式为
您最近一年使用:0次