名校
解题方法
1 . 对下列图示实验的描述正确的是
|
|
| A.所示的实验:制取FeCO3 | B.所示的实验:用NaOH溶液滴定盐酸 |
|
|
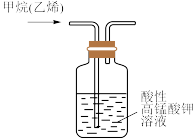
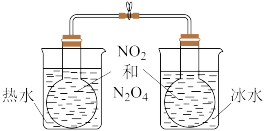
| C.用装置除去甲烷中的乙烯,以得到纯净的甲烷 | D.所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断 的正反应是吸热反应 的正反应是吸热反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 .  催化剂可以催化
催化剂可以催化 脱除烟气中的
脱除烟气中的 ,主反应为:
,主反应为: ;已知:偏钒酸铵
;已知:偏钒酸铵 本身在水中溶解度不大,草酸
本身在水中溶解度不大,草酸 能与含钒粒子形成易溶于水的物质。
能与含钒粒子形成易溶于水的物质。
(1)催化剂的制备。分别称取定量的 与
与 混合,加入草酸溶液,在
混合,加入草酸溶液,在 水浴下加热搅拌至完全溶解,加入一定量的
水浴下加热搅拌至完全溶解,加入一定量的 粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到
粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到 催化剂。加入草酸的作用是
催化剂。加入草酸的作用是__________ 。
(2)催化剂的使用。在脱硝过程中,若烟气中含有 ,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是
,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是__________ 。
(3)催化剂的回收。通过如下工艺流程可以回收其中的金属。
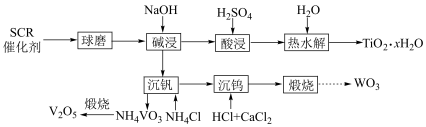
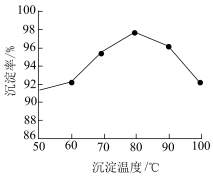
①该流程中钒以 的形式沉淀出来。沉钒率是指
的形式沉淀出来。沉钒率是指 沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过
沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过 时,沉钒率下降的可能原因是
时,沉钒率下降的可能原因是__________ 。(写一条即可)
②“酸浸”后钛主要以 形式存在,“热水解”反应的离子方程式为
形式存在,“热水解”反应的离子方程式为__________ 。
③煅烧 的化学方程式为
的化学方程式为__________ 。
④为测定回收所得 样品的纯度,进行如下实验:称取
样品的纯度,进行如下实验:称取 灼烧后的样品,用稀硫酸溶解、定容得到
灼烧后的样品,用稀硫酸溶解、定容得到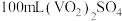 溶液。量取
溶液。量取 溶液放入锥形瓶中,加入过量的
溶液放入锥形瓶中,加入过量的 溶液,再用
溶液,再用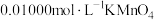 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。已知:
。已知: ;
;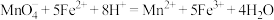 。计算
。计算 样品的纯度(写出计算过程)
样品的纯度(写出计算过程)__________ 。
 催化剂可以催化
催化剂可以催化 脱除烟气中的
脱除烟气中的 ,主反应为:
,主反应为: ;已知:偏钒酸铵
;已知:偏钒酸铵 本身在水中溶解度不大,草酸
本身在水中溶解度不大,草酸 能与含钒粒子形成易溶于水的物质。
能与含钒粒子形成易溶于水的物质。(1)催化剂的制备。分别称取定量的
 与
与 混合,加入草酸溶液,在
混合,加入草酸溶液,在 水浴下加热搅拌至完全溶解,加入一定量的
水浴下加热搅拌至完全溶解,加入一定量的 粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到
粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到 催化剂。加入草酸的作用是
催化剂。加入草酸的作用是(2)催化剂的使用。在脱硝过程中,若烟气中含有
 ,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是
,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是(3)催化剂的回收。通过如下工艺流程可以回收其中的金属。

①该流程中钒以
 的形式沉淀出来。沉钒率是指
的形式沉淀出来。沉钒率是指 沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过
沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过 时,沉钒率下降的可能原因是
时,沉钒率下降的可能原因是
②“酸浸”后钛主要以
 形式存在,“热水解”反应的离子方程式为
形式存在,“热水解”反应的离子方程式为③煅烧
 的化学方程式为
的化学方程式为④为测定回收所得
 样品的纯度,进行如下实验:称取
样品的纯度,进行如下实验:称取 灼烧后的样品,用稀硫酸溶解、定容得到
灼烧后的样品,用稀硫酸溶解、定容得到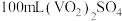 溶液。量取
溶液。量取 溶液放入锥形瓶中,加入过量的
溶液放入锥形瓶中,加入过量的 溶液,再用
溶液,再用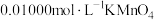 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。已知:
。已知: ;
;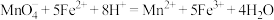 。计算
。计算 样品的纯度(写出计算过程)
样品的纯度(写出计算过程)
您最近半年使用:0次
3 . 常温下,0.1mol/L醋酸钠溶液的 。下列相关说法
。下列相关说法不正确 的是
 。下列相关说法
。下列相关说法A.醋酸钠溶液显碱性的原因是: |
B.常温下,醋酸钠溶液中: |
C.向10mL上述溶液中滴加5滴饱和 溶液, 溶液,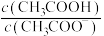 逐渐增大 逐渐增大 |
| D.在pH均为9的醋酸钠溶液和氨水中,水的电离程度:醋酸钠溶液>氨水 |
您最近半年使用:0次
名校
4 . 《礼记·内则》记载:“冠带垢,和灰清漱;衣裳垢,和灰清浣”古人洗涤衣裳冠带,用的就是浸泡过草木灰的溶液。下列说法错误的是
A.草木灰中含有 | B.草木灰做肥料时可与铵态氮肥混合施用 |
| C.浸泡过草木灰的溶液呈碱性 | D.加热浸泡过草木灰的溶液可增强其去油污能力 |
您最近半年使用:0次
5 . 根据下列实验操作与现象所得出的结论正确的是
| 选项 | 实验操作与现象 | 结论 |
| A | 向4mL0.1mol/LK2CrO4溶液中缓慢滴加lmol/L稀硝酸,溶液由黄色变为橙色 | 增大c(H+)有利于 转化为 转化为 |
| B | 将0.1mol/LFeCl3溶液与0.2mol/LKI溶液等体积混合,振荡,再加入2mLCCl4,振荡,静置后下层为紫红色 | I-和Fe3+反应有一定的限度 |
| C | 室温下,用pH计测量等浓度的CH3COONa和HCOONa溶液的pH,前者大于后者 | Ka(CH3COOH)>Ka(HCOOH) |
| D | 室温下,向浓度均为0.05mol/L的NaI和NaCl的混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)>Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
6 . 室温下,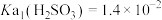 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。
实验1:用pH试纸测量0.1
 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。
实验2:向0.1
 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。
实验3:向 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
下列所得结论正确的是
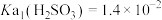 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。实验1:用pH试纸测量0.1

 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。实验2:向0.1

 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。实验3:向
 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。实验4:向
 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。下列所得结论正确的是
A.实验1可知0.1  溶液中存在: 溶液中存在: |
B.实验2得到的溶液中存在: |
C.实验3中随着水不断加入,溶液中 的值逐渐变小 的值逐渐变小 |
D.实验4中发生反应的离子方程式为 |
您最近半年使用:0次
2023-11-10更新
|
432次组卷
|
3卷引用:江苏省无锡市2023-2024学年高三上学期期中教学质量调研测试化学试卷题
7 . 从废定影液[主要含有 、
、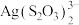 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关从废定影液中回收Ag和
,用苯萃取分液。下列有关从废定影液中回收Ag和 的说法正确的是
的说法正确的是
 、
、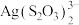 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关从废定影液中回收Ag和
,用苯萃取分液。下列有关从废定影液中回收Ag和 的说法正确的是
的说法正确的是| A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体 |
B.配制 溶液时,向其中加入少量NaOH溶液, 溶液时,向其中加入少量NaOH溶液, 的值增大 的值增大 |
C.燃烧 生成Ag和 生成Ag和 , , 既是还原剂又是氧化剂 既是还原剂又是氧化剂 |
| D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层 |
您最近半年使用:0次
名校
8 . 化学与生产、生活密切相关,请根据下列要求作答。
I.桂皮中含有的肉桂醛(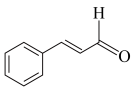 )是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
)是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
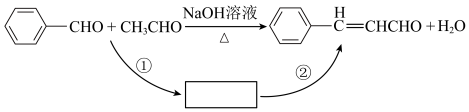
(1)已知反应①为加成反应,则反应②的反应类型为___________ 。
Ⅱ.蔗糖是重要的二糖,在一定条件下会发生水解反应。
(2)①为检验蔗糖的水解产物,需要配制银氨溶液,过程为:向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水到沉淀恰好完全溶解,写出配制银氨溶液总反应的离子方程式___________ 。
②补充完整验证蔗糖水解产物中含有葡萄糖的实验方案:取少量的10%的蔗糖溶液于试管中,___________ 。(实验中须使用的试剂有:10%的H2SO4溶液、10%的NaOH溶液、银氨溶液、pH试纸)
Ⅲ.硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)一炭粉还原法制备,原理为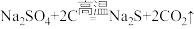 。其主要流程如下:
。其主要流程如下:
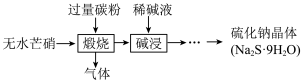
(3)上述流程中采用稀碱液比用热水更好,理由是___________ 。
(4)已知: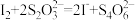 。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:
。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:
a.取试样10.00g配成500.00ml溶液。
b.取所配溶液25.00mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.05000mo1·L-1I2溶液滴定至终点,用去5.00mLI2溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为___________ 。
②判断步骤b中滴定终点的现象为___________ 。
③计算试样中Na2S2O3·5H2O的质量分数(写出计算过程)。___________ 。
I.桂皮中含有的肉桂醛(
 )是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
)是一种食用香料,广泛应用于牙膏、洗涤剂、糖果等,工业上可通过苯甲醛和乙醛为原料制得,研究发现实际反应要通过①②两步反应完成制备,如下图所示:
(1)已知反应①为加成反应,则反应②的反应类型为
Ⅱ.蔗糖是重要的二糖,在一定条件下会发生水解反应。
(2)①为检验蔗糖的水解产物,需要配制银氨溶液,过程为:向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水到沉淀恰好完全溶解,写出配制银氨溶液总反应的离子方程式
②补充完整验证蔗糖水解产物中含有葡萄糖的实验方案:取少量的10%的蔗糖溶液于试管中,
Ⅲ.硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)一炭粉还原法制备,原理为
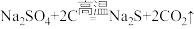 。其主要流程如下:
。其主要流程如下:
(3)上述流程中采用稀碱液比用热水更好,理由是
(4)已知:
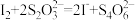 。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:
。上述所制得的Na2S·9H2O晶体中含有NaS2S2O3·5H2O(相对质量为248)等杂质。为测定产品的成分,进行下列实验:a.取试样10.00g配成500.00ml溶液。
b.取所配溶液25.00mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.05000mo1·L-1I2溶液滴定至终点,用去5.00mLI2溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为
②判断步骤b中滴定终点的现象为
③计算试样中Na2S2O3·5H2O的质量分数(写出计算过程)。
您最近半年使用:0次
名校
9 . 室温下,下列实验探究方案设计正确且能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向紫色石蕊溶液中通入过量二氧化硫,溶液先变红后褪色 | SO2为酸性氧化物且具有漂白性 |
| B | 将20℃ 0.5 mol·L-1CH3COONa溶液加热到40℃,用pH传感器测量溶液的pH | 温度对CH3COO-水解平衡的影响 |
| C | 向Na2CO3溶液中滴加浓盐酸,反应产生的气体直接通入Na2SiO3溶液中 | 非金属性:C>Si |
| D | 向浓度均为0.01mol·L-1的Na2CO3和Na2SO4的混合液中滴少量0.01mol·L-1的BaCl2溶液 | Ksp(BaCO3>Ksp(BaSO4) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
10 . 单宁酸 -硫酸体系中,低品位软锰矿(
-硫酸体系中,低品位软锰矿( 质量分数为29%)中的Mn(Ⅳ)可被还原为
质量分数为29%)中的Mn(Ⅳ)可被还原为 而浸出。其浸出过程如图所示。
而浸出。其浸出过程如图所示。 完全水解,生成的没食子酸和葡萄糖物质的量之比为
完全水解,生成的没食子酸和葡萄糖物质的量之比为___________ 。
(2)写出葡萄糖还原 生成
生成 的离子反应方程式:
的离子反应方程式:________________ 。
(3)浸出前后软锰矿与浸取渣的X-射线衍射图如图所示,衍射峰的强度能一定程度反映晶体的质量分数等信息。指出图中 对应衍射峰强度变化的原因:
对应衍射峰强度变化的原因:____________ 。
准确称取 软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使
软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使 完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为
完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。
。
①实验室现配 溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配
溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配 溶液进行的补充实验是
溶液进行的补充实验是_________ 。
② 完全氧化后加热溶液的目的是
完全氧化后加热溶液的目的是____________ 。
③计算该条件下软锰矿中锰元素的浸出率
____________ 。[ 。写出计算过程]
。写出计算过程]
(5)90℃下,控制单宁酸用量和反应时间相同,测得 对锰元素浸出率的影响如图所示。
对锰元素浸出率的影响如图所示。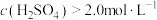 时,锰元素浸出率降低的可能原因是
时,锰元素浸出率降低的可能原因是___________ 。
 -硫酸体系中,低品位软锰矿(
-硫酸体系中,低品位软锰矿( 质量分数为29%)中的Mn(Ⅳ)可被还原为
质量分数为29%)中的Mn(Ⅳ)可被还原为 而浸出。其浸出过程如图所示。
而浸出。其浸出过程如图所示。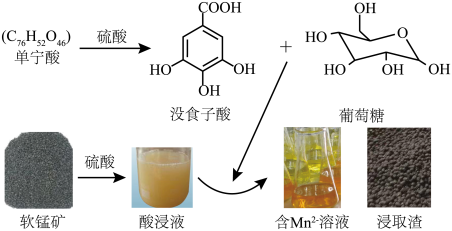
 完全水解,生成的没食子酸和葡萄糖物质的量之比为
完全水解,生成的没食子酸和葡萄糖物质的量之比为(2)写出葡萄糖还原
 生成
生成 的离子反应方程式:
的离子反应方程式:(3)浸出前后软锰矿与浸取渣的X-射线衍射图如图所示,衍射峰的强度能一定程度反映晶体的质量分数等信息。指出图中
 对应衍射峰强度变化的原因:
对应衍射峰强度变化的原因: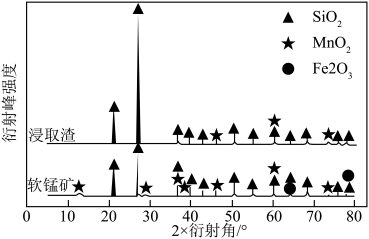
准确称取
 软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使
软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使 完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为
完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。
。①实验室现配
 溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配
溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配 溶液进行的补充实验是
溶液进行的补充实验是②
 完全氧化后加热溶液的目的是
完全氧化后加热溶液的目的是③计算该条件下软锰矿中锰元素的浸出率

 。写出计算过程]
。写出计算过程](5)90℃下,控制单宁酸用量和反应时间相同,测得
 对锰元素浸出率的影响如图所示。
对锰元素浸出率的影响如图所示。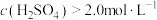 时,锰元素浸出率降低的可能原因是
时,锰元素浸出率降低的可能原因是
您最近半年使用:0次
2023-05-07更新
|
472次组卷
|
2卷引用:江苏省南通市2023届高三下学期第三次调研测试化学试题