名校
解题方法
1 . 对下列图示实验的描述正确的是
|
|
| A.所示的实验:制取FeCO3 | B.所示的实验:用NaOH溶液滴定盐酸 |
|
|
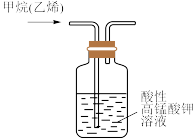
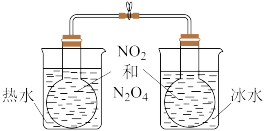
| C.用装置除去甲烷中的乙烯,以得到纯净的甲烷 | D.所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断 的正反应是吸热反应 的正反应是吸热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 常温下,0.1mol/L醋酸钠溶液的 。下列相关说法
。下列相关说法不正确 的是
 。下列相关说法
。下列相关说法A.醋酸钠溶液显碱性的原因是: |
B.常温下,醋酸钠溶液中: |
C.向10mL上述溶液中滴加5滴饱和 溶液, 溶液,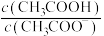 逐渐增大 逐渐增大 |
| D.在pH均为9的醋酸钠溶液和氨水中,水的电离程度:醋酸钠溶液>氨水 |
您最近一年使用:0次
名校
解题方法
3 . 室温下,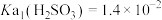 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。
实验1:用pH试纸测量0.1
 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。
实验2:向0.1
 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。
实验3:向 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
下列所得结论正确的是
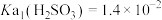 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。实验1:用pH试纸测量0.1

 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。实验2:向0.1

 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。实验3:向
 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。实验4:向
 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。下列所得结论正确的是
A.实验1可知0.1  溶液中存在: 溶液中存在: |
B.实验2得到的溶液中存在: |
C.实验3中随着水不断加入,溶液中 的值逐渐变小 的值逐渐变小 |
D.实验4中发生反应的离子方程式为 |
您最近一年使用:0次
2023-11-10更新
|
440次组卷
|
3卷引用:江苏省无锡市2023-2024学年高三上学期期中教学质量调研测试化学试卷题
4 . 从废定影液[主要含有 、
、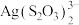 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关从废定影液中回收Ag和
,用苯萃取分液。下列有关从废定影液中回收Ag和 的说法正确的是
的说法正确的是
 、
、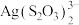 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关从废定影液中回收Ag和
,用苯萃取分液。下列有关从废定影液中回收Ag和 的说法正确的是
的说法正确的是| A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体 |
B.配制 溶液时,向其中加入少量NaOH溶液, 溶液时,向其中加入少量NaOH溶液, 的值增大 的值增大 |
C.燃烧 生成Ag和 生成Ag和 , , 既是还原剂又是氧化剂 既是还原剂又是氧化剂 |
| D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层 |
您最近一年使用:0次
5 . 铜、银位于周期表中第ⅠB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有 、
、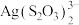 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关从废定影液中回收Ag和
,用苯萃取分液。下列有关从废定影液中回收Ag和 的说法正确的是
的说法正确的是
 、
、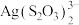 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关从废定影液中回收Ag和
,用苯萃取分液。下列有关从废定影液中回收Ag和 的说法正确的是
的说法正确的是| A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体 |
B.配制 溶液时,向其中加入少量NaOH溶液, 溶液时,向其中加入少量NaOH溶液, 的值增大 的值增大 |
C.灼烧 生成 生成 和 和 ,该反应每生成 ,该反应每生成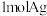 转移3mol电子 转移3mol电子 |
| D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层 |
您最近一年使用:0次
2023-01-19更新
|
228次组卷
|
2卷引用:江苏省宿迁市青华中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
6 . NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______ (用离子方程式说明)。
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c( )
)_______ (填“等于”“大于”或“小于”)0.1mol∙L-1NH4HSO4溶液中的c( )。
)。
(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。
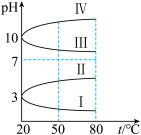
①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4Al(SO4)2溶液的pH随温度变化的原因是_______ 。
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c c
c 3cAl3=
3cAl3=_______ molL1。
(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c
 c
c 3cAl3=
3cAl3=(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2022-12-01更新
|
1387次组卷
|
57卷引用:江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题
江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题四川省武胜烈面中学校2019-2020学年高二上学期期中考试化学试题山东省淄博市2019-2020学年高二上学期期中考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题黑龙江省大庆铁人中学2023-2024学年高二上学期期中考试化学试题(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷2016-2017学年内蒙古包头九中高二上10月月考化学卷2016-2017学年四川省成都七中高二上11月考试化学卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题河北省永年县第二中学2017-2018学年高二12月月考化学试题宁夏育才中学2017-2018学年高二上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题高二人教版选修4 期末学业测评(一)山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月5日 《每日一题》人教选修4-周末培优吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》(已下线)2019年12月30日 《每日一题》人教版(选修4)——盐类水解的影响因素河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用安徽省皖南八校2022届高三上学期摸底联考化学试题(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)3.3.3 盐类水解的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)四川省资阳中学2021-2022学年高二下学期3月月考化学试题(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)专题十三水溶液中的离子平衡四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题(已下线)盐类的水解山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷
解题方法
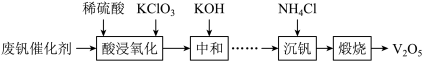
7 . 五氧化二钒(V2O5)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有V2O5、VOSO4及少量Fe2O3、Al2O3等杂质)回收V2O5的部分工艺流程如下:
已知:
a.常温下,部分含钒物质在水中的溶解性见下表:
b.+5价钒在溶液中的主要存在形式与溶液pH的关系见下表;
(1)“酸浸、氧化”时VO2+发生反应的离子方程式为_______ 。
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是_______ 。
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可简单表示为: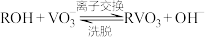 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ (填“酸性”或“碱性”),理由是_______ 。
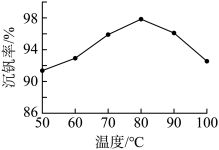
②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。题14-1图中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是_______ 。
(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图所示,加热分解NH4VO3制备V2O5需要控制的温度为_______ (写出计算推理过程)。

(5)新型催化材料磷化钒(VP)的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有_______ 个。


已知:
a.常温下,部分含钒物质在水中的溶解性见下表:
| 物质 | V2O5 | VOSO4 | (VO2)2SO4 | NH4VO3 |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可简单表示为:
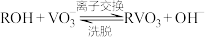 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。题14-1图中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是

(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图所示,加热分解NH4VO3制备V2O5需要控制的温度为

(5)新型催化材料磷化钒(VP)的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有

您最近一年使用:0次
8 . 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。水体除NO 主要有电化学法。催化还原法等。
主要有电化学法。催化还原法等。
(1)电化学去除弱酸性水体中NO 的反应原理如图1所示:
的反应原理如图1所示:

①作负极的物质是____ 。
②正极的电极反应式是____ 。
③取两份完全相同的含NO 废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为
废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为____ 。废浓中NO 的去除率较低的是NO
的去除率较低的是NO (“废液A”和“废液B”),NO
(“废液A”和“废液B”),NO 的去除率低的原因是
的去除率低的原因是____ 。
(2)纳米Fe-Ni去除废液中的NO (Ni不参与反应)。
(Ni不参与反应)。
①在酸性条件下,Fe与NO 反应生成Fe2+和NH
反应生成Fe2+和NH ,则反应的离子方程式为
,则反应的离子方程式为_____ 。
②初始pH=2.0的废液,加入一定量的纳米Fe-Ni,反应一段时间后,废液中出现大量白色絮状沉淀物,过滤后白色沉淀物在空气中逐渐变成红褐色。产生上述现象的原因是_____ 。
 主要有电化学法。催化还原法等。
主要有电化学法。催化还原法等。(1)电化学去除弱酸性水体中NO
 的反应原理如图1所示:
的反应原理如图1所示:
①作负极的物质是
②正极的电极反应式是
③取两份完全相同的含NO
 废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为
废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为 的去除率较低的是NO
的去除率较低的是NO (“废液A”和“废液B”),NO
(“废液A”和“废液B”),NO 的去除率低的原因是
的去除率低的原因是(2)纳米Fe-Ni去除废液中的NO
 (Ni不参与反应)。
(Ni不参与反应)。①在酸性条件下,Fe与NO
 反应生成Fe2+和NH
反应生成Fe2+和NH ,则反应的离子方程式为
,则反应的离子方程式为②初始pH=2.0的废液,加入一定量的纳米Fe-Ni,反应一段时间后,废液中出现大量白色絮状沉淀物,过滤后白色沉淀物在空气中逐渐变成红褐色。产生上述现象的原因是
您最近一年使用:0次
9 . 下列事实中,不能用勒夏特列原理解释的是
A.对于平衡体系 ,增大压强(缩小容积)可使颜色变深 ,增大压强(缩小容积)可使颜色变深 |
B.合成氨工业上,采用高压以提高 的产率 的产率 |
| C.氯水宜保存在低温、避光条件下 |
D.用 溶液除铁锈,增大 溶液除铁锈,增大 溶液浓度,除铁锈速率加快 溶液浓度,除铁锈速率加快 |
您最近一年使用:0次
名校
10 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 用pH试纸分别测量NaNO2和CH3COONa溶液的pH | NaNO2溶液的pH约为8,CH3COONa溶液的pH约为9 | Ka(HNO2)>Ka(CH3COOH) |
| B | 用pH试纸测量0.1mol·L-1NaHSO3溶液的pH | pH约为5 | 溶液中HSO 的电离>水解 的电离>水解 |
| C | 向滴有酚酞的氨水中加入CH3COONH4固体 | 溶液的红色变浅 | CH3COONH4溶液呈酸性 |
| D | 室温下,向密闭容器中充入NO2,达平衡后,再慢慢扩大容器体积 | 最终容器中气体颜色比初次平衡时浅 | 2NO2(g) N2O4(g)(无色)该平衡正向移动 N2O4(g)(无色)该平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-11更新
|
497次组卷
|
4卷引用:江苏扬州市宝应县2021-2022学年高二上学期期中调研化学试题