名校
解题方法
1 . 能够使CH3COONa稀溶液水解程度增大且溶液碱性也增强的条件是
| A.加水 | B.升温 | C.加压 | D.加CH3COONa固体 |
您最近一年使用:0次
2021-06-02更新
|
236次组卷
|
6卷引用:2018版化学(苏教版)高考总复习专题八课时跟踪训练--盐类的水解
2018版化学(苏教版)高考总复习专题八课时跟踪训练--盐类的水解陕西省西安中学2020-2021学年高二上学期期末考试化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.3.2 影响盐类水解的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
名校
解题方法
2 . 三氯化六氨合钴(III){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以活性炭为催化剂,合成三氯化六氨合钴(III)晶体的流程如图
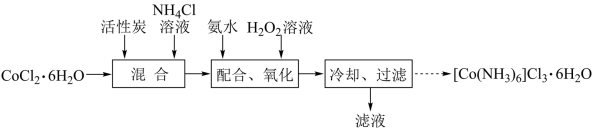
已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3·6H2O在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)“混合”时加入的NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是_______ 。
(2)在如图所示实验装置的三颈烧瓶中,发生“配合、氧化”。

①控制三颈烧瓶中溶液温度为60℃的原因是_______ 。
②“配合”步骤安排在“氧化”步骤之前的目的是_______ 。
③向三颈烧瓶中滴加氨水的实验操作为_______ 。加入H2O2溶液时发生反应的离子方程式为_______ 。
(3)设计由过滤后的滤渣获取[Co(NH3)6]Cl3·6H2O的实验方案:向滤渣中加入80℃左右的热水,_______ ,低温干燥。(实验中须使用的试剂:浓盐酸、无水乙醇)

已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3·6H2O在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)“混合”时加入的NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是
(2)在如图所示实验装置的三颈烧瓶中,发生“配合、氧化”。

①控制三颈烧瓶中溶液温度为60℃的原因是
②“配合”步骤安排在“氧化”步骤之前的目的是
③向三颈烧瓶中滴加氨水的实验操作为
(3)设计由过滤后的滤渣获取[Co(NH3)6]Cl3·6H2O的实验方案:向滤渣中加入80℃左右的热水,
您最近一年使用:0次
名校
解题方法
3 . 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。
下列有关说法正确的是
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 将FeCl3溶液加热片刻 | 溶液颜色变深 |
| 2 | 向FeCl3溶液中通入少量HCl气体 | 溶液颜色变浅 |
| 3 | 向FeCl3溶液中加入少量(NH4)2SO4固体 | 溶液颜色变浅 |
| 4 | 向FeCl3溶液中加入少量NaHCO3固体 | 产生红褐色沉淀,溶液中出现大量气泡 |
| A.实验1中FeCl3溶液加热至沸腾会生成红褐色沉淀 |
| B.实验2中Fe3+水解反应平衡逆向移动,化学平衡常数变小 |
| C.实验3得到的溶液中有3c(Fe3+)+c(H+)=c(NH3·H2O)+c(Cl-)+c(OH-) |
D.实验4中反应的离子方程式为Fe3++HCO +H2O=Fe(OH)3↓+CO2↑ +H2O=Fe(OH)3↓+CO2↑ |
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
| A.室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
| B.地下钢铁管道用导线连接锌块或者外接电源的负极,均可以减缓管道的腐蚀 |
C.0.1mol•L-1CH3COOH溶液加水稀释后,溶液中 的值增大 的值增大 |
| D.SO2属于电解质 |
您最近一年使用:0次
5 . 下列说法正确的是
| A.向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 |
| B.反应N2(g)+3H2(g)⇌2NH3(g)(ΔH<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 |
| C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀。 |
| D.反应CO(g)+3H2(g)==CH4(g)+H2O(g)在一定条件下能自发进行,则该反应的ΔH>0 |
您最近一年使用:0次
名校
解题方法
6 . 根据下列实验操作和现象所得到的结论不 正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 在0.1 mol·L-1Na2CO3溶液中,加2滴酚酞试液显浅红色,微热,红色加深 | 盐类水解是放热反应 |
| B | 取1 mL 0.1 mol·L-1FeCl3溶液,滴加5mL0.1 mol·L-1KI溶液,振荡,再加入5 mL CCl4,振荡,静置,取上层液体,向其中滴加KSCN溶液,显血红色 | KI和FeCl3反应有一定的限度 |
| C | 用铂丝蘸取少量某无色溶液进行焰色反应,火焰呈黄色 | 该物质中一定含有钠元素 |
| D | 向2.0mL浓度均为0.1mol/LKCl和KI混合溶液中滴加2滴0.1mol/L的AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列实验能达到预期目的的是
| 选项 | 实验操作 | 实验结论 |
| A | 室温下,用pH试纸测得:0.1mol/L Na2SO3溶液的 pH 约为10;0.1 mol/L NaHSO3溶液的 pH 约为5 | 证明HSO 结合H+的能力比 SO 结合H+的能力比 SO 强 强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明 Na2CO3溶液中存在水解平衡 |
| C | 配制FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 用pH试纸测得:Na2CO3溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出H+的能力比H2CO3的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.P的第一电离能与电负性均大于S |
| B.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2mol |
| C.高温下,TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)∆H>0能自发进行,其原因是∆S>0 |
D.向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中 减小 减小 |
您最近一年使用:0次
2021-04-30更新
|
290次组卷
|
4卷引用:江苏省南京市中华中学2021届高三第二次适应性训练(选修)化学试题
江苏省南京市中华中学2021届高三第二次适应性训练(选修)化学试题山东省日照市2021届高三第二次模拟考试化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)(已下线)必刷卷01-2022年高考化学考前信息必刷卷(山东专用)
名校
解题方法
9 . 有3种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与HCl②NH4Cl与NaCl ③NH4Cl与NH3·H2O(混合溶液呈碱性),下列各项排序正确的是
| A.溶液的pH:①<②<③ | B.溶液中水的电离程度:②<③<① |
C.溶液中c(NH ):①<③<② ):①<③<② | D.溶液中c(NH3·H2O):③<①<② |
您最近一年使用:0次
2021-04-30更新
|
653次组卷
|
6卷引用:江苏省苏州大学附属中学2023-2024学年高二上学期12月月考化学试题
江苏省苏州大学附属中学2023-2024学年高二上学期12月月考化学试题宁夏银川一中2020-2021学年高二下学期期中考试化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)山东省淄博市高青县第一中学2021-2022学年高二上学期期中考试化学试题天津市第一中学2022-2023学年高二上学期月考化学试题
10 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡等。
(1)已知部分弱酸的电离常数如下表:
①室温下,某CH3COONa溶液呈碱性的原因是___________ (用离子方程式表示)
②向NaCN溶液通入少量的CO2,反应的离子方程式是___________ 。
(2)羟胺(NH2OH)可看成是NH3的1个氢原子被取代的产物,其水溶液显弱碱性,原因与NH3在水溶液中相似,请用电离方程式表示其原因:___________ 。
(3)“亚硫酸盐法”吸收烟气中的SO2.室温条件下,将烟气通入(NH4)2SO3,溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图1所示,b点时溶液pH=7,则n(NH ):n(HSO
):n(HSO )=
)= ___________ 。


(4)废水中氨氮(以NH3、NH 形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化除去。
形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化除去。
已知①NH3比NH 更易被氧化。
更易被氧化。
②NaClO除去水中氨氮的反应历程如下: NaClO +H2O HClO +NaOH;NH3+HClO =NH2Cl+H2O; 2NH2C1+ HClO= N2↑+ 3HCl+H2O
HClO +NaOH;NH3+HClO =NH2Cl+H2O; 2NH2C1+ HClO= N2↑+ 3HCl+H2O
控制含氨氮废水的量和加入NaClO的量一定,测定反应相同时间,氨氮的去除率与溶液初始pH的关系如图2。
①当pH<6时,氨氮去除率随溶液pH升高而升高的原因是___________ 。
②当pH>10时,氨氮去除率随溶液pH升高而降低的原因是___________ 。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25 ℃) | Ka=1.7 ×10-5 | Ka=4.3×10-10 | Ka1=5.0 ×10-7 Ka2=5.6 ×10-11 |
①室温下,某CH3COONa溶液呈碱性的原因是
②向NaCN溶液通入少量的CO2,反应的离子方程式是
(2)羟胺(NH2OH)可看成是NH3的1个氢原子被取代的产物,其水溶液显弱碱性,原因与NH3在水溶液中相似,请用电离方程式表示其原因:
(3)“亚硫酸盐法”吸收烟气中的SO2.室温条件下,将烟气通入(NH4)2SO3,溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图1所示,b点时溶液pH=7,则n(NH
 ):n(HSO
):n(HSO )=
)= 

(4)废水中氨氮(以NH3、NH
 形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化除去。
形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化除去。已知①NH3比NH
 更易被氧化。
更易被氧化。②NaClO除去水中氨氮的反应历程如下: NaClO +H2O
 HClO +NaOH;NH3+HClO =NH2Cl+H2O; 2NH2C1+ HClO= N2↑+ 3HCl+H2O
HClO +NaOH;NH3+HClO =NH2Cl+H2O; 2NH2C1+ HClO= N2↑+ 3HCl+H2O控制含氨氮废水的量和加入NaClO的量一定,测定反应相同时间,氨氮的去除率与溶液初始pH的关系如图2。
①当pH<6时,氨氮去除率随溶液pH升高而升高的原因是
②当pH>10时,氨氮去除率随溶液pH升高而降低的原因是
您最近一年使用:0次



