1 . (1)已知25℃时,醋酸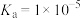 ,0.1mol/L的醋酸溶液的pH=
,0.1mol/L的醋酸溶液的pH=___________ 。
(2)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水③NH4HSO4 ④NH4Cl⑤(NH4)2Fe(SO4)2,c(NH4+)由大到小顺序是___________ (用序号表示)。
(3)可溶性铝盐常用作净水剂的原因:___________ (用离子方程式表示)。
(4)将等体积等物质的量浓度的CH3COONa和NaF溶液混合:c(CH3COOH)+c(HF)___________ c(OH-)-c(H+)(填 > 或 < 或 =)
(5)某温度下,测得的0.001mol/LHCl溶液中,由水电离出来的 。求此温度下,水离子积常数为
。求此温度下,水离子积常数为___________ 。在此温度下,将 的HCl溶液和
的HCl溶液和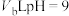 的
的 溶液混合均匀,测得溶液的pH=7,则
溶液混合均匀,测得溶液的pH=7,则
___________ 。
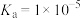 ,0.1mol/L的醋酸溶液的pH=
,0.1mol/L的醋酸溶液的pH=(2)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水③NH4HSO4 ④NH4Cl⑤(NH4)2Fe(SO4)2,c(NH4+)由大到小顺序是
(3)可溶性铝盐常用作净水剂的原因:
(4)将等体积等物质的量浓度的CH3COONa和NaF溶液混合:c(CH3COOH)+c(HF)
(5)某温度下,测得的0.001mol/LHCl溶液中,由水电离出来的
 。求此温度下,水离子积常数为
。求此温度下,水离子积常数为 的HCl溶液和
的HCl溶液和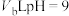 的
的 溶液混合均匀,测得溶液的pH=7,则
溶液混合均匀,测得溶液的pH=7,则
您最近半年使用:0次
名校
2 . 在含有弱电解质的溶液中,往往有多个平衡共存。
(1)常温下,将 的某一元酸
的某一元酸 溶液和
溶液和 的
的 溶液等体积混合后溶液的
溶液等体积混合后溶液的 大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是___________ (填字母)。
A.
B.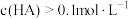
C.
(2)常温下,向 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳元素的各种微粒(
溶液,溶液中含碳元素的各种微粒( 因逸出未画出)的物质的量分数(纵轴)随溶液的
因逸出未画出)的物质的量分数(纵轴)随溶液的 变化的部分情况如图所示。
变化的部分情况如图所示。

①在同一溶液中,
___________ (填“能”或“不能”)大量共存。
②当 时,溶液中
时,溶液中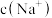
___________ (填“>”、“<”或“=”)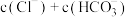 。
。
③ 时,
时, 水解反应的平衡常数
水解反应的平衡常数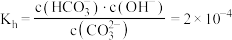 ,当溶液中
,当溶液中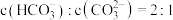 时,溶液的
时,溶液的
___________ 。
(3) 虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。
① 在溶液中分三步水解:
在溶液中分三步水解:


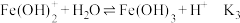
上述水解反应的平衡常数 由大到小的顺序是
由大到小的顺序是___________ 。
②通过控制条件,上述水獬产物聚合,生成聚合氯化铁,其离子方程式为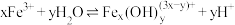 ,欲使平衡正向移动可采用的措施是
,欲使平衡正向移动可采用的措施是___________ (填字母)。
a.加水稀释 b.降温 c.加入
(1)常温下,将
 的某一元酸
的某一元酸 溶液和
溶液和 的
的 溶液等体积混合后溶液的
溶液等体积混合后溶液的 大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是A.

B.
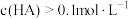
C.

(2)常温下,向
 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳元素的各种微粒(
溶液,溶液中含碳元素的各种微粒( 因逸出未画出)的物质的量分数(纵轴)随溶液的
因逸出未画出)的物质的量分数(纵轴)随溶液的 变化的部分情况如图所示。
变化的部分情况如图所示。
①在同一溶液中,

②当
 时,溶液中
时,溶液中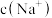
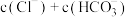 。
。③
 时,
时, 水解反应的平衡常数
水解反应的平衡常数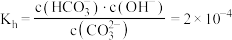 ,当溶液中
,当溶液中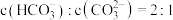 时,溶液的
时,溶液的
(3)
 虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。①
 在溶液中分三步水解:
在溶液中分三步水解:

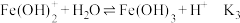
上述水解反应的平衡常数
 由大到小的顺序是
由大到小的顺序是②通过控制条件,上述水獬产物聚合,生成聚合氯化铁,其离子方程式为
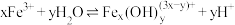 ,欲使平衡正向移动可采用的措施是
,欲使平衡正向移动可采用的措施是a.加水稀释 b.降温 c.加入

您最近半年使用:0次
名校
3 . 一定温度下,稀释 的
的 溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
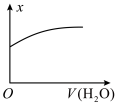
 的
的 溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
A. 水解的平衡常数 水解的平衡常数 | B. |
C. | D. |
您最近半年使用:0次
名校
解题方法
4 . 物质的量的浓度相等的以下溶液① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ ,其中
,其中 的浓度由大到小的顺序为
的浓度由大到小的顺序为
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ ,其中
,其中 的浓度由大到小的顺序为
的浓度由大到小的顺序为| A.①③②④ | B.①③④② | C.③①②④ | D.③①④② |
您最近半年使用:0次
2023-11-22更新
|
506次组卷
|
3卷引用:甘肃省天水市第一中学2023-2024学年高二下学期开学化学试题
甘肃省天水市第一中学2023-2024学年高二下学期开学化学试题黑龙江省哈尔滨市第九中学校2023一一2024学年高二上学期期中考试化学试卷(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
5 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究浓度对平衡的影响 | 向平衡体系FeCl3+ 3KSCN Fe (SCN)3+ 3KCl中加入适量KC1固体 Fe (SCN)3+ 3KCl中加入适量KC1固体 | 若溶液的颜色变浅,说明:生成物浓度增加,平衡逆向移动 |
| B | 探究盐类水解程度 | 常温下, 用pH计测得0. lmol/L 弱酸盐:Na2A、Na2B溶液pH值为a、b | 若a>b,则水解程度A2-<B2- |
| C | 比较Ksp(AgCl)和Ksp(AgI)的大小 | 取2mL 0.1mol·L-1AgNO3溶液于试管中,加lmL 0.1 mol·L-1NaCl溶液,待不再有白色沉淀产生后加入1mL 0.1 mol·L-1KI 溶液 | 若产生黄色沉淀,说明:K sp(AgCl)> Ksp(AgI) |
| D | 比较CH3COOH的Ka 和H2CO3的Ka1 | 向盛有2mL1mol/L醋酸的试管中滴加1mol/L的Na2CO3溶液 | 若有气泡产生,则CH3COOH的Ka大于H2CO3的Ka1 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-01-25更新
|
586次组卷
|
3卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二下学期开学考试化学试题
名校
6 . 在一定条件下, 溶液中存在水解平衡:
溶液中存在水解平衡: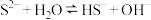 ,下列说法正确的是
,下列说法正确的是
 溶液中存在水解平衡:
溶液中存在水解平衡: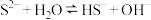 ,下列说法正确的是
,下列说法正确的是| A.稀释溶液,水解平衡常数增大 | B.加入 固体,溶液 固体,溶液 减小 减小 |
C.升高温度, 减小 减小 | D.加入 固体, 固体, 浓度减小 浓度减小 |
您最近半年使用:0次
2022-11-18更新
|
355次组卷
|
20卷引用:【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题
【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(实验班)上学期期末考试化学试题四川省射洪县射洪中学2018-2019学年高二下学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题河南省南阳市第一中学2019-2020学年高二上学期第四次月考化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题安徽省六安市新安中学2020-2021学年高二下学期入学考试(重点班)化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题四川省成都七中2022届高三上学期入学测化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)河北省衡水市第十四中学2021-2022学年高二上学期二调考试化学试题河南省桐柏县第一高级中学2021-2022学年高二上学期期中考试化学试题(已下线)第23讲 盐类水解 (练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨工业大学附属中学校2021-2022学年高二上学期期中考试化学试题吉林省长春市第二中学2023-2024学年高二上学期11月期中考试化学试题黑龙江省海林市朝鲜族中学2023-2024学年高二上学期第三次考试(期末)化学试卷
名校
7 . FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验。回答下列问题:
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为_______ ;装置中F的作用:_______ 。
(2)硬质玻璃管直接接入收集器的优点是_______ 。
Ⅱ.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1mol/L FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++ 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii:2Cu2+ + 4SCN-= 2CuSCN↓+ (SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。 小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为
(2)硬质玻璃管直接接入收集器的优点是
Ⅱ.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1mol/L FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++ 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii:2Cu2+ + 4SCN-= 2CuSCN↓+ (SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2 mL 0.1mol·L-1 CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近半年使用:0次
名校
解题方法
8 . 常温下,下列有关电解质溶液的说法不正确 的是
A.向Na2CO3溶液中通入NH3,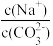 减小 减小 |
B.将0.1 mol·L-1的K2C2O4溶液从25 ℃升温至35 ℃,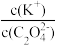 增大 增大 |
C.向0.1 mol·L-1的HF溶液中滴加NaOH溶液至中性, =1 =1 |
D.向0.1 mol·L-1的CH3COONa溶液中加入少量水,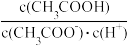 增大 增大 |
您最近半年使用:0次
2022-03-23更新
|
546次组卷
|
17卷引用:甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题
甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题广西防城港市2018届高三1月模拟考试理综化学试题【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题备考突破2020高三化学专题强化集训——盐类水解中的三大守恒的应用夯基提能2020届高三化学选择题对题专练 ——选修四化学反应原理——电离平衡常数及其影响因素专练 (2)【百强校】天津市静海区第一中学2020届高三下学期第七周周末训练化学试题天津市实验中学2020届高三下学期4月第一次测试化学试题广东省云浮市2018-2019学年高二上学期期末考试化学试题解题达人.化学选择题(2021全国卷)巩固小卷02河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高三上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题安徽省桐城中学2022-2023学年高二上学期月考(1)化学试题河南省郑州市2021-2022学年高二上学期期末考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解
名校
9 . 下列有关溶液中粒子浓度的关系式中,正确的是
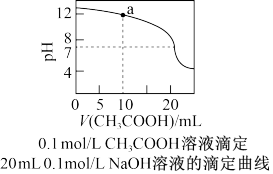

| A.pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>① |
| B.0.1mol·L-1某二元强碱弱酸盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| C.上图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
| D.上图a点溶液中各离子浓度的关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
您最近半年使用:0次
2022-03-05更新
|
199次组卷
|
9卷引用:2016届甘肃西北师大附中高三下第五次诊断理科化学试卷
2016届甘肃西北师大附中高三下第五次诊断理科化学试卷2018届高三一轮复习化学:微考点62-攻克盐类水解平衡(已下线)2018年11月10日——《每日一题》 人教 必修4-周末培优(已下线)2019年1月6日 《每日一题》人教选修4-每周一测(已下线)2019年11月9日《每日一题》选修4—— 周末培优湖南省武冈二中2020-2021学年高二上学期开学考试化学试题广东省广州市禺山高级中学2019-2020学年高二下学期期中考试化学试题云南省玉溪澄江市第一中学2021-2022学年下学期高二开学考试化学试题天津市第四十二中学2022-2023学年高二上学期末考试化学试题
名校
解题方法
10 . 为了配制 浓度与
浓度与 浓度比为
浓度比为 的溶液,可在
的溶液,可在 溶液中加入
溶液中加入
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
 浓度与
浓度与 浓度比为
浓度比为 的溶液,可在
的溶液,可在 溶液中加入
溶液中加入①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
| A.① | B.② | C.③ | D.④ |
您最近半年使用:0次
2022-02-20更新
|
212次组卷
|
35卷引用:2015-2016学年甘肃省天水一中高二上学期第一次段中考试化学试卷
2015-2016学年甘肃省天水一中高二上学期第一次段中考试化学试卷甘肃省永昌四中2019-2020学年高二上学期期末考试化学试题甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题(已下线)2011-2012学年福建省四地六校高二下学期第一次联考化学试卷(已下线)2012年苏教版高中化学选修4 3.3盐类的水解练习卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷2014-2015云南省玉溪第一中学高二上学期期末考试化学试卷2014-2015四川省德阳市第五中学高二下学期第一次月考化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2015-2016学年浙江省绍兴一中高二上期中测试化学试卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年广东省湛江市高二上学期期末质检化学试卷2015-2016学年四川省绵阳南山中学高二4月月考化学试卷2016-2017学年黑龙江省鸡西市第十九中学高二上学期期末考试化学试卷宁夏石嘴山市第三中学2016-2017学年高二下学期第二次(5月)月考化学试题河南省洛阳名校2017-2018学年高二上学期第二次联考化学试题陕西岐山县2017—2018学年度第一学期期末质量检测高二化学(理科)黑龙江省大庆十中2018-2019学年高二上学期期末考试化学试题【全国百强校】贵州省铜仁市思南中学2018-2019学年高二上学期期末考试化学试题陕西省吴起高级中学2019-2020学年高二上学期第一次月考(能力卷)化学试题吉林省辽源市田家炳高级中学2019-2020学年高二12月月考化学试题黑龙江省大庆市第十中学2019-2020学年高二上学期期末考试化学试题2020届高三化学选修4二轮专题练——盐类水解章节强化【精编25题】黑龙江省牡丹江市穆棱市第一中学2019-2020学年高二上学期期末考试化学试题北京市第四中学2019-2020学年高二上学期期末考试化学试题福建省福清市龙西中学2018-2019学年高二下学期期中考试化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题吉林省长春市第二实验中学2020-2021学年高二上学期期中考试化学试题江苏省苏州工业园区星海实验中学2019-2020学年高二下学期期中考试化学试卷福建省莆田第十五中学2018-2019学年高二下学期期中测试化学试题北京市平谷区2021-2022学年高二上学期期末化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期11月测试化学试题新疆乌苏市第一中学2021-2022学年高二12月月考化学试题四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题广东省深圳市龙华高级中学2022-2023学年高二上学期第二次段考化学试题



