1 . 久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
(1)写出Fe2+水解的离子方程式______ ;要抑制FeSO4水解,可以采取的措施是______ 。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2⇌4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______ 。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______ 。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______ 。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200mol•L-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______ mol•L-1。

(1)写出Fe2+水解的离子方程式
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2⇌4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200mol•L-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=
您最近一年使用:0次
名校
2 . 硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
1.硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________ 。
2.向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。____
3.为了使Na2S溶液中 的比值变小,可适量加入(或通入)的物质是
的比值变小,可适量加入(或通入)的物质是_______ 。
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物____________ (填“相同”或“不同”),由此可知硫酸氧化性的强弱与______________ 有关。
4.在如图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)________ H2S,原因是__________ 。

5.常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
表中c(OH-)基本不变的原因是________ 。
1.硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式
2.向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。
3.为了使Na2S溶液中
 的比值变小,可适量加入(或通入)的物质是
的比值变小,可适量加入(或通入)的物质是a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物
4.在如图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)

5.常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
| 温度(℃) | c(氨水)(mol/L) | 电离程度(%) | c(OH-)(mol/L) |
0 | 16.56 | 9.098 | 1.507×10-2 |
10 | 15.16 | 10.18 | 1.543×10-2 |
20 | 13.63 | 11.2 | 1.527×10-2 |
您最近一年使用:0次
名校
解题方法
3 . 10℃时,在烧杯中加入0.1mol·L-1的NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为_____ 。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度_____ (填“大于”或“小于”)NaHCO3。
(3)丙同学认为:要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH_____ 8.3(填“>”“<”或“=”),说明甲正确;若pH____ 8.3(填“>”“<”或“=”),说明乙正确。
(4)丁同学设计如图实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中澄清石灰水变浑浊,说明____ (填“甲”或“乙”)推测正确。

(5)将一定体积0.1mol·L-1的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断____ (填“甲”或“乙”)推测正确,原因是____ 。
| 温度/℃ | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度
(3)丙同学认为:要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH
(4)丁同学设计如图实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中澄清石灰水变浑浊,说明

(5)将一定体积0.1mol·L-1的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断
您最近一年使用:0次
2021-04-29更新
|
104次组卷
|
3卷引用:上海市控江中学2023-2024学年高二上学期等级班阶段测验卷二 化学试题
解题方法
4 . 化学社团小组的同学在测试Na2SO3溶液的pH时,遇到了困惑。为此,决心重新实验,揭开奥秘。请你也参与交流讨论。
a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论
(1)实验操作①所得溶液的物质的量浓度为___________ ;实验操作②中除酒精灯、玻璃棒、三角架及隔绝空气的设备外,还需要的仪器有___________ 。
(2)给Na2SO3•7H2O加热时为何要隔绝空气,请以简要的文字给以说明。___________
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是___________ 。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是(简要的文字和离子方程式给以说明)__________ 。
(5)请你设计简单的实验方案,给上述分析猜想及解释加以佐证。并简单叙述实验步骤、现象和结论。________ 。
a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论
(1)实验操作①所得溶液的物质的量浓度为
(2)给Na2SO3•7H2O加热时为何要隔绝空气,请以简要的文字给以说明。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是(简要的文字和离子方程式给以说明)
(5)请你设计简单的实验方案,给上述分析猜想及解释加以佐证。并简单叙述实验步骤、现象和结论。
您最近一年使用:0次
名校
解题方法
5 . 有研究认为,在强碱性溶液中,反应 分三步进行
分三步进行
①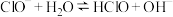 ,
,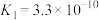
②……
③ ,
,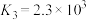
下列说法错误的是
 分三步进行
分三步进行①
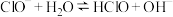 ,
,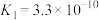
②……
③
 ,
,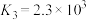
下列说法错误的是
A.氧化性: |
B.升温, 增大 增大 |
C.第②步反应: |
D. ,故反应速率:③>① ,故反应速率:③>① |
您最近一年使用:0次
2023-03-31更新
|
146次组卷
|
2卷引用:上海市南模、控江、曹二、进才中学四校2022-2023学年高三下学期3月联考化学试题
名校
6 . 下列物质① 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液
(1)属于非电解质的是:___________ ;属于强电解质的是:___________ ;属于弱电解质的是:___________ ;既不是电解质也不是非电解质,常温下能导电的物质是___________ (均填序号)。
(2)写出①的电离方程式___________ 。
(3)向⑦的溶液中滴加几滴浓盐酸,平衡___________ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中
___________ (填“增大”、“减小”或者“不变”),
___________ (填“增大”、“减小”或者“不变”)。
(4)将 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是___________ (结合有关离子方程式说明)。
(5)将标准状况下2.24L⑥缓慢通入 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系___________ 。
(6)将足量⑥缓慢通入 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度___________ 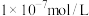 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH___________ (填“增大”、“减小”、或“不变”)。
 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液(1)属于非电解质的是:
(2)写出①的电离方程式
(3)向⑦的溶液中滴加几滴浓盐酸,平衡


(4)将
 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是(5)将标准状况下2.24L⑥缓慢通入
 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系(6)将足量⑥缓慢通入
 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度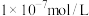 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH
您最近一年使用:0次
解题方法
7 . 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂

对实验现象的“解释或结论”错误的是

对实验现象的“解释或结论”错误的是
| 选项 | 实验现象 | 解释或结论 |
| A | a中溶液褪色 | 还原性:SO32- <I- |
| B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O HSO3-+OH-,所以滴入酚酞变红; HSO3-+OH-,所以滴入酚酞变红;Ba2++SO32-→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2011·辽宁·一模
解题方法
8 . 下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入溴水中 | 验证SO2具有漂白性 |
| B | 在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色褪去 | 验证Na2CO3溶液中存在水解平衡 |
| C | 淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸 | 检验淀粉水解产物有还原性 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10-11高三上·上海崇明·期末
9 . 根据有关化学原理,下列判断正确的是( )
| A.80℃时,Na2SO4溶液的pH<7,则溶液呈酸性 |
| B.若盐AB溶于水时溶液的温度降低,则AB一定发生了水解 |
| C.若弱酸HA的酸性弱于弱酸HB,则同浓度钠盐溶液的碱性在相同条件下:NaA>NaB |
| D.25℃时,与同浓度的稀硫酸反应,锌粒的速率一定比铁粉快 |
您最近一年使用:0次
名校
10 . 20℃时,有两种 0.1mol/L 的一元弱酸的钠盐 NaX 和 NaY,向 NaX 溶液中通入 CO2 只能生成 HX 和NaHCO3;向 NaY 溶液中通入 CO2 能生成 HY 和 Na2CO3,下列说法正确的是
| A.酸性:HY>HX |
| B.HX 和 HY 酸性相同但比 H2CO3 弱 |
| C.结合 H+的能力:Y->CO32->X->HCO3- |
| D.同浓度下,溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 |
您最近一年使用:0次



