1 . 下列说法正确的是

A.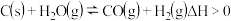 ,其他条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 ,其他条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
B.常温下,反应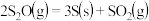 能自发进行,则其 能自发进行,则其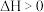 |
C.常温下,pH均为10的NaOH溶液与 溶液中,水的电离程度相同 溶液中,水的电离程度相同 |
D.保持温度不变,向稀氨水中缓慢通入 ,溶液中 ,溶液中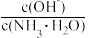 的值减小 的值减小 |
您最近一年使用:0次
2 . 一定温度下将分散系X加水稀释10倍后,所做判断正确的是
| 选项 | X | 稀释后 |
| A | 0. 1mol·L-1NaCl | c(Na+)和c(H+)都减小 |
| B | 0. 1mol·L-1Na2CO3 | c( HCO )/ c ( CO )/ c ( CO )减小 )减小 |
| C | 0. 1mol·L-1氨水 | n(H+)·n(OH-)增大 |
| D | 一定量的CuS悬浊液 | c( Cu2+ )和c(S2- )都增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下表中实验操作、现象与结论对应关系错误的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 分别向两份相同的 溶液中加入少量等体积等浓度 溶液中加入少量等体积等浓度 ,溶液和 ,溶液和 溶液 溶液 | 加 溶液的试管中产生气体速率快 溶液的试管中产生气体速率快 |  催化效率大于 催化效率大于 |
| B | 用 试纸测定 试纸测定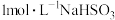 溶液的酸碱性 溶液的酸碱性 | 测得 |  的电离程度大于水解程度 的电离程度大于水解程度 |
| C | 向含有酚酞的 溶液中加入少量 溶液中加入少量 溶液 溶液 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由 水解引起的 水解引起的 |
| D | 在过量的 溶液中滴加少量 溶液中滴加少量 溶液,再加入少量 溶液,再加入少量 溶液 溶液 | 先产生白色 沉淀,后产生黑色 沉淀,后产生黑色 沉淀 沉淀 | 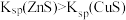 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 现有浓度为0.10 mol·L-1的氨水和 0.10 mol·L-1的 NH4Cl溶液。回答下列问题:
(1)氨水显碱性的原因是______ (用电离方程式表示)。向氨水中加入 NH4Cl 固体,氨水的电离程度______ (填“增大”“减小”或“不变”),原因是______ ,溶液的 pH______ (填“增大”“减小”或“不变”)。
(2)NH4Cl 溶液显______ 性,原因是______ (用离子方程式表示)。室温下,若向 NH4Cl溶液中加入少量氨水,使溶液中c( )=c(Cl-),则溶液的 pH
)=c(Cl-),则溶液的 pH______ 7(填“>”“<”或“=”)。
(3)Mg(OH)2浊液中存在 Mg(OH)2 的沉淀溶解平衡。向此浊液中加入浓的 NH4Cl溶液,观察到的现象是______ ,反应原理是______ (用离子方程式表示)。
(1)氨水显碱性的原因是
(2)NH4Cl 溶液显
 )=c(Cl-),则溶液的 pH
)=c(Cl-),则溶液的 pH(3)Mg(OH)2浊液中存在 Mg(OH)2 的沉淀溶解平衡。向此浊液中加入浓的 NH4Cl溶液,观察到的现象是
您最近一年使用:0次
解题方法
5 . 根据下列实验得出的结论或达到的目的错误的是
| 实验 | 结论或目的 | |
| A | 室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5 | 结合H+的能力: |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 配制FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铁粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL0.2mol·L-1NaOH溶液中滴入2滴0.1md·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀 | 溶度积: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列比较中正确的是
| A.相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液 c(H+):③>②>① |
B.相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中c(NH ):③>①>② ):③>①>② |
| C.相同pH的溶液:①CH3COONa溶液、②NaHCO3溶液、③NaClO溶液中c(Na+):①>②>③ |
| D.同浓度、同体积的溶液:①NaAlO2溶液、②NH4Cl溶液、③NaNO3溶液中pH:②>③>① |
您最近一年使用:0次
2021-02-20更新
|
1290次组卷
|
4卷引用:安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题
安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题重庆实验中学2020-2021学年高二上学期第一阶段测试化学试题宁夏银川一中2021-2022学年高二上学期期中考试化学试题(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)
7 . 某同学将适量的石灰石颗粒置于 饱和溶液中,后续实验过程及典型实验现象如图所示。
饱和溶液中,后续实验过程及典型实验现象如图所示。
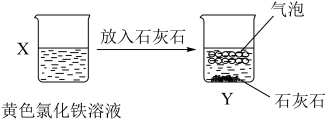

请回答下列问题:
(1) 能促进水的电离,其理由是
能促进水的电离,其理由是______ ;若饱和 溶液的
溶液的 ,则由水电离出的
,则由水电离出的 和
和 乘积为
乘积为______ 。
(2)用一个离子方程式解释Y中现象:______ 。
(3)将Y放置一昼夜后,将所得到的透明液体(记为Z)转移到另一个烧杯,并进行相应的实验(见图),则X、Z中分散质粒子直径较大的是______ ,将X溶液蒸干并灼烧,最后得到的固体物质是______ (填化学式)。
(4)若向 溶液中加入足量镁粉,充分反应后不可能得到的物质是
溶液中加入足量镁粉,充分反应后不可能得到的物质是______ (填字母序号)。
A.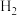 B.
B. C.
C. D.
D.
 饱和溶液中,后续实验过程及典型实验现象如图所示。
饱和溶液中,后续实验过程及典型实验现象如图所示。

请回答下列问题:
(1)
 能促进水的电离,其理由是
能促进水的电离,其理由是 溶液的
溶液的 ,则由水电离出的
,则由水电离出的 和
和 乘积为
乘积为(2)用一个离子方程式解释Y中现象:
(3)将Y放置一昼夜后,将所得到的透明液体(记为Z)转移到另一个烧杯,并进行相应的实验(见图),则X、Z中分散质粒子直径较大的是
(4)若向
 溶液中加入足量镁粉,充分反应后不可能得到的物质是
溶液中加入足量镁粉,充分反应后不可能得到的物质是A.
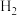 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
8 . 下列有关NH4A1(SO4)2溶液叙述正确的是
A.该溶液中,Na+、Ca2+、Cl-、 可以大量共存 可以大量共存 |
B.该溶液中,K+、CH3COO-、 、F-可以大量共存 、F-可以大量共存 |
| C.NH4Al(SO4)2可作净水剂,其净水原理;Al3++ 3H2O=Al(OH)3↓+3H+ |
D.和足量Ba(OH)2稀溶液反应:2Ba2+ 5OH-+NH +Al3++2SO +Al3++2SO =2BaSO4↓ +NH3·H2O+AlO =2BaSO4↓ +NH3·H2O+AlO +2H2O +2H2O |
您最近一年使用:0次
2021-01-31更新
|
377次组卷
|
3卷引用:安徽省合肥市2021年高三第一次教学质量检测化学试题
名校
解题方法
9 . 按要求填空
(1)氯化铝溶液蒸干、灼烧后得到的固体物质是___ 。
(2)25℃时,将pH=3 的醋酸和 pH=11 的氢氧化钠溶液等体积混合后溶液呈___ 性(填“酸”“中”或“碱”)。
(3)相同浓度的下列溶液中:①CH3COONH4②CH3COONa③CH3COOH 中,其中 c(CH3COO-)由大到小的顺序是___ ;
(4) 常温下,pH=11 的 CH3COONa 溶液,其中水电离出来的 c(OH-)=___ ,在 pH=3 的 CH3COOH 溶液中,水电离出来的 c(H+)=___ 。
(1)氯化铝溶液蒸干、灼烧后得到的固体物质是
(2)25℃时,将pH=3 的醋酸和 pH=11 的氢氧化钠溶液等体积混合后溶液呈
(3)相同浓度的下列溶液中:①CH3COONH4②CH3COONa③CH3COOH 中,其中 c(CH3COO-)由大到小的顺序是
(4) 常温下,pH=11 的 CH3COONa 溶液,其中水电离出来的 c(OH-)=
您最近一年使用:0次
10 . 回答下列问题:
(1)下列物质: ①Cu ②SO2 ③冰醋酸 ④NaHCO3 ⑤Cu(OH )2 ⑥H2SO4溶液 ⑦NaCl,其中属于电解质的是________________ (填序号)。
(2) 时,
时,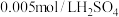 溶液的pH=
溶液的pH=________________ 。
(3)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离常数如下表:
①由上表数据可知,Na2SO3溶液显_____ 性,其原因是________________________ (用离子方程式表示)。
② 时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为
时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为 _______________ (用字母表示)。
③工业上可用氨水除去尾气SO2,将SO2通入氨水中,当c(OH-)降至1.0×10-8mol/L时,溶液中的 =
= __________________________ (保留三位有效数字)。
(1)下列物质: ①Cu ②SO2 ③冰醋酸 ④NaHCO3 ⑤Cu(OH )2 ⑥H2SO4溶液 ⑦NaCl,其中属于电解质的是
(2)
 时,
时,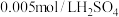 溶液的pH=
溶液的pH=(3)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离常数如下表:
| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
①由上表数据可知,Na2SO3溶液显
②
 时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为
时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为 ③工业上可用氨水除去尾气SO2,将SO2通入氨水中,当c(OH-)降至1.0×10-8mol/L时,溶液中的
 =
=
您最近一年使用:0次



