名校
解题方法
1 . 亚硫酸钠( )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
实验(一)探究 水解的影响因素。
水解的影响因素。
I.配制250 mL 0.1 mol⋅L
 溶液。
溶液。
(1)称取 固体的质量为
固体的质量为______ g。
(2)配制该溶液不需要选择下列仪器中的______ (填标号)。
(3)实验①④_______ (填“能”或“不能”)得出单一变量对实验结果的影响规律。
(4)实验①和②的目的是___________ 。
(5)某同学预测 ,实验测得
,实验测得 ,
,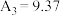 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是_______ (答1条);将实验③的溶液降温至25℃(标记为⑤),测得溶液pH为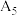 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:_______ ,设计实验证明你的猜想:________ ,猜想成立。
实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L
 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。
(6)该 样品纯度为
样品纯度为______ %,若滴定前仰视读数,滴定终点俯视读数,则测得的结果______ (填“偏高”“偏低”或“无影响”)。
 )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:实验(一)探究
 水解的影响因素。
水解的影响因素。I.配制250 mL 0.1 mol⋅L

 溶液。
溶液。(1)称取
 固体的质量为
固体的质量为(2)配制该溶液不需要选择下列仪器中的
A. B.
B. C.
C.
| 序号 | 0.1 mol⋅L  溶液 /mL 溶液 /mL | 水/mL | 水浴温度/℃ | 测得pH |
| ① | 10.0 | 0 | 25 | 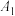 |
| ② | 5.0 | 5 | 25 | 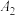 |
| ③ | 10.0 | 0 | 40 |  |
| ④ | 8.0 | 2 | 35 |  |
(3)实验①④
(4)实验①和②的目的是
(5)某同学预测
 ,实验测得
,实验测得 ,
,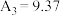 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是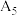 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L

 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。(6)该
 样品纯度为
样品纯度为
您最近一年使用:0次
2024-02-03更新
|
120次组卷
|
4卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
解题方法
2 . 下列实验中,操作、现象及结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将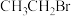 与 与 溶液共热,冷却后,取上层水溶液先加入足量稀硝酸再加入 溶液共热,冷却后,取上层水溶液先加入足量稀硝酸再加入 溶液 溶液 | 产生淡黄色沉淀 | 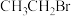 含有溴原子 含有溴原子 |
| B | 向 溶液中滴加 溶液中滴加 溶液 溶液 | 产生白色沉淀 |  和 和 ,发生了相互促进的水解反应 ,发生了相互促进的水解反应 |
| C | 将乙醇与浓硫酸共热至140℃所得气体直接通入酸性 溶液中 溶液中 |  溶液褪色 溶液褪色 | 乙醇发生消去反应,气体一定是乙烯 |
| D | 取适量 溶液于试管中,测定pH值,然后加热一段时间,冷却至原温度,再次测定该溶液的pH值 溶液于试管中,测定pH值,然后加热一段时间,冷却至原温度,再次测定该溶液的pH值 | 加热后pH值变小 | 证明 的水解为吸热过程 的水解为吸热过程 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 .  溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓
溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓 ,黄色加深(b)。
,黄色加深(b)。
已知: (黄色);浓度较小时
(黄色);浓度较小时 (用
(用 表示)几乎无色
表示)几乎无色
取溶液进行如下实验,对现象的分析不正确 的是
 溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓
溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓 ,黄色加深(b)。
,黄色加深(b)。已知:
 (黄色);浓度较小时
(黄色);浓度较小时 (用
(用 表示)几乎无色
表示)几乎无色取溶液进行如下实验,对现象的分析
A.测溶液a的 ,证明 ,证明 发生了水解 发生了水解 |
B.将溶液a滴入沸水中并加热,有丁达尔效应,说明加热能促进 水解 水解 |
C.加入浓 , , 与 与 对溶液颜色变化、 对溶液颜色变化、 浓度大小的影响是一致的 浓度大小的影响是一致的 |
D.向b中加入 后,黄色褪至几乎无色,说明 后,黄色褪至几乎无色,说明 能抑制 能抑制 水解 水解 |
您最近一年使用:0次
2023-12-11更新
|
352次组卷
|
11卷引用:湖南省娄底市第五中学2021-2022学年高三下学期第三次模拟考试化学试题
湖南省娄底市第五中学2021-2022学年高三下学期第三次模拟考试化学试题北京市朝阳区2022届高三一模化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(河北专用)(已下线)必刷卷04-2022年高考化学考前信息必刷卷(河北专用)北京市第一七一中学2022届高三下学期三模化学试题北京市一0一中学2022-2023学年高二下学期期中考试化学试题北京市育英学校2023-2024学年高三上学期(12月)统测五化学学科试题(已下线)北京市第四中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)(已下线)专题05 盐类的水解-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)北京市第四中学2023-2024学年高三下学期一模模拟化学试题
名校
4 . 下列实验方案能达到实验目的的是
| 选项 | A | B | C | D |
| 目的 | 制备并收集乙酸乙酯 | 证明温度对平衡的影响 | 证明AgI的溶解度小于AgCl | 蒸干氯化锰溶液制 |
| 实验方案 |  |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-10更新
|
292次组卷
|
4卷引用:湖南省永州市第四中学2022届高三下学期期中考试化学试题
湖南省永州市第四中学2022届高三下学期期中考试化学试题河北省五校联盟(保定市第一中学等)2021-2022学年高三下学期3月模拟考试化学试题(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题
5 . 下列实验所得结论错误的是
| 选项 | 实验 | 结论 |
| A | 将0.1 mol∙L−1氨水稀释成0.01 mol∙L−1,测得pH由11.1变成10.6 | 稀释后,NH3·H2O的电离程度减小 |
| B | 室温下,用pH计分别测定同浓度的NaClO和CH3COONa溶液的pH,NaClO溶液pH大 | 酸性:HClO<CH3COOH |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO 水解引起的 水解引起的 |
| D | 在AgCl悬浊液中滴入数滴0.1 mol∙L−1 KI溶液,生成黄色沉淀 | 同温下溶解度:AgCl>AgI |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列说法正确的是
A.对于 的 的 溶液,升高温度,溶液pH上升 溶液,升高温度,溶液pH上升 |
| B.温度越高,化学反应速率越快,化学平衡常数越大 |
C.常温下,能证明乙酸是弱电解质的事实是 CH3COONa溶液pH大于7 CH3COONa溶液pH大于7 |
| D.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
您最近一年使用:0次
名校
7 . 已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是
注:加热为微热,忽略溶液体积变化。
| ① | ② | ③ | ④ |
 0.1mol/L Fe2(SO4)3溶液 |  酸化的0.1mol/L Fe2(SO4)3溶液 |  酸化的0.1mol/L Fe2(SO4)3溶液 |  0.1mol/L FeCl3溶液 |
| 加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
| A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3 |
| B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响 |
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O [FeCl4(H2O)2]- [FeCl4(H2O)2]- |
| D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动 |
您最近一年使用:0次
2020-03-03更新
|
358次组卷
|
6卷引用:湖南省长沙市雅礼中学2020届高三下学期第六次月考理科综合化学试题
名校
解题方法
8 . 下列实验及现象不能得出相应结论的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向2mL0.01mol·L-1的FeCl3溶液中 滴入1滴KSCN溶液,再加入足量铜 粉,充分震荡 | 溶液变为红色,加入 铜粉后红色褪去,变 为浅蓝色 | Fe3+比Cu2+的氧化性强 |
| B | 将滴有酚酞的Na2CO3溶液加热 | 溶液红色变深 | 证明Na2CO3在溶液中 的水解为吸热反应 |
| C | 先向2mL0.01mol·L-1Na2S溶液中滴加 2滴0.01mol·L-1ZnSO4溶液,再滴加 2滴0.01mol·L-1AgNO3溶液 | 开始有白色沉淀生成 ;后又有黑色沉淀 | Ksp(ZnS)>Ksp(Ag2S) |
| D | 分别向2mL0.01mol·L-1的MgCl2、BeCl2 溶液中滴加过量0.02mol·L-1NaOH溶液, 并充分震荡 | 前者有白色沉淀生成,后者先有白色 沉淀生成,后沉淀消失 | 证明Be(OH)2为 两性氢氧化物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 下列实验能达到预期目的
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.lmol·L-1NaClO 溶液和 0.1 mol·L-1CH3COONa 溶液的 pH | 比较 HClO 和 CH3COOH 的酸性强弱 |
| B | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向l0mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L-1 FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-09-25更新
|
887次组卷
|
2卷引用:湖南省永州市2018届高三上学期第一次模拟考试化学试题
名校
10 . 下列有关说法正确的是
A.常温下,向 溶液中加入少量盐酸,溶液中 溶液中加入少量盐酸,溶液中 的值增大 的值增大 |
B.反应 常温下能自发进行,则该反应的 常温下能自发进行,则该反应的 |
C.一定条件下, 碘蒸气和 碘蒸气和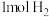 充分混合反应生成HI并放热 充分混合反应生成HI并放热 ,则该反应的热化学方程式为: ,则该反应的热化学方程式为: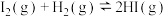 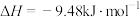 |
D.同温同压下, 在光照和点燃条件下的 在光照和点燃条件下的 不同 不同 |
您最近一年使用:0次



