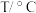解题方法
1 . 广泛用于火箭、原子能、电子工业等领域。以矿石(主要成分是Be2SiO4,含少量MnO等)为原料制备Be的工艺流程如图所示。
(1)“烧结”之前,将铍矿石粉碎成粉末,其目的是_____ 。
(2)“除锰”时发生反应的离子方程式为_____ 。“除锰”时温度不宜过高,原因是_____ 。
(3)制备无水 过程如下:将
过程如下:将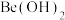 溶于盐酸,蒸发浓缩、冷却结晶得到
溶于盐酸,蒸发浓缩、冷却结晶得到 ;加热
;加热 和
和 的混合物得到无水
的混合物得到无水 ,该化学方程式为
,该化学方程式为_____ 。也可以用 固体替代
固体替代 ,
, 的作用是
的作用是_____ 。
(4)1828年德国化学家维勒用金属钾还原熔融的氯化铍而得到 。若将这个反应设计成原电池,则在电池的
。若将这个反应设计成原电池,则在电池的_____ (填“正”或“负”)极得到Be。
(5)铍和铝的化学性质相似,下列叙述错误的是_____ (填字母)。
A.铍是一种轻金属,能与冷水反应
B.常温下,BeCl2溶液的pH<7
C.氧化铍的熔点高、耐酸碱腐蚀

(1)“烧结”之前,将铍矿石粉碎成粉末,其目的是
(2)“除锰”时发生反应的离子方程式为
(3)制备无水
 过程如下:将
过程如下:将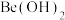 溶于盐酸,蒸发浓缩、冷却结晶得到
溶于盐酸,蒸发浓缩、冷却结晶得到 ;加热
;加热 和
和 的混合物得到无水
的混合物得到无水 ,该化学方程式为
,该化学方程式为 固体替代
固体替代 ,
, 的作用是
的作用是(4)1828年德国化学家维勒用金属钾还原熔融的氯化铍而得到
 。若将这个反应设计成原电池,则在电池的
。若将这个反应设计成原电池,则在电池的(5)铍和铝的化学性质相似,下列叙述错误的是
A.铍是一种轻金属,能与冷水反应
B.常温下,BeCl2溶液的pH<7
C.氧化铍的熔点高、耐酸碱腐蚀
您最近一年使用:0次
2 . 钛白(主要成分 )用途广泛,常用来作高级白色颜料,在造纸工业中作填充剂,合成纤维中作消光剂。制取钛白的方法主要有两种,利用钛铁矿(主要成分
)用途广泛,常用来作高级白色颜料,在造纸工业中作填充剂,合成纤维中作消光剂。制取钛白的方法主要有两种,利用钛铁矿(主要成分 ,还有
,还有 、FeO、
、FeO、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题: 形式存在,
形式存在, 在80℃左右水解生成
在80℃左右水解生成
(1)下列状态的钛元素形成的微粒中,电离其最外层的一个电子所需能量最小的是_______(填序号)。
(2)“酸溶”时主要成分发生反应的离子方程式为_______ 。
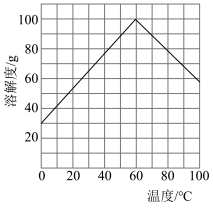
(3)“还原”时应选择合适的试剂X是_______ (填化学式);已知绿矾的溶解度随温度变化的曲线如图所示,从溶液中获得绿矾的操作为_______ 、过滤、洗涤、干燥。 在水中或潮湿空气中会发烟,可用于制作烟幕弹,原因是
在水中或潮湿空气中会发烟,可用于制作烟幕弹,原因是_______ (化学方程式表示)
(5)以上两种工艺流程中,请说出方法一优于方法二的理由_______ (写出一条即可)。
(6) 在自然界中有三种形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种形态中最稳定的一种,其晶胞如图所示,钛的配位数为
在自然界中有三种形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种形态中最稳定的一种,其晶胞如图所示,钛的配位数为_______ ,该晶体的密度为_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、
,用含a、b、 的代数式表示)。
的代数式表示)。
 )用途广泛,常用来作高级白色颜料,在造纸工业中作填充剂,合成纤维中作消光剂。制取钛白的方法主要有两种,利用钛铁矿(主要成分
)用途广泛,常用来作高级白色颜料,在造纸工业中作填充剂,合成纤维中作消光剂。制取钛白的方法主要有两种,利用钛铁矿(主要成分 ,还有
,还有 、FeO、
、FeO、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题: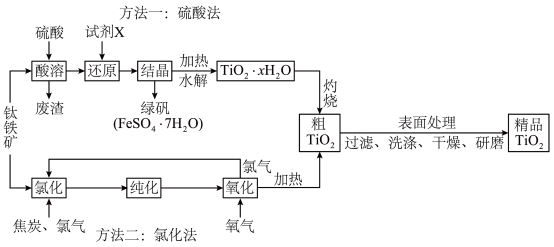
 形式存在,
形式存在, 在80℃左右水解生成
在80℃左右水解生成
(1)下列状态的钛元素形成的微粒中,电离其最外层的一个电子所需能量最小的是_______(填序号)。
A.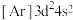 | B. | C.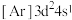 | D.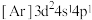 |
(2)“酸溶”时主要成分发生反应的离子方程式为
(3)“还原”时应选择合适的试剂X是
 在水中或潮湿空气中会发烟,可用于制作烟幕弹,原因是
在水中或潮湿空气中会发烟,可用于制作烟幕弹,原因是(5)以上两种工艺流程中,请说出方法一优于方法二的理由
(6)
 在自然界中有三种形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种形态中最稳定的一种,其晶胞如图所示,钛的配位数为
在自然界中有三种形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种形态中最稳定的一种,其晶胞如图所示,钛的配位数为 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、
,用含a、b、 的代数式表示)。
的代数式表示)。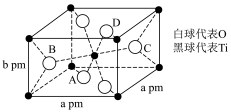
您最近一年使用:0次
解题方法
3 . 以菱锰矿(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备锂电池的正电极材料
等)为原料制备锂电池的正电极材料 的流程如图所示。
的流程如图所示。
(1)基态Mn原子价层电子排布式为________________ 。
(2)“浸渣1”主要成分有 和
和________________ (填化学式);提高“酸浸”速率的措施有________________ (答一条)。“除铁铝”中 的作用是
的作用是________________ 。
(3)“电解”中废液可循环用于________ (填名称)工序。用过一硫酸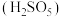 替代“电解”氧化
替代“电解”氧化 生成
生成 ,写出离子方程式:
,写出离子方程式: ________________ (注: 第一步完全电离,第二步电离程度小)。
第一步完全电离,第二步电离程度小)。
(4)在不同温度下,合成 中的
中的 、
、 和
和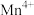 的含量与温度的关系如表所示:
的含量与温度的关系如表所示:
由此可以确定,在上述温度范围内,锰元素的平均价态的变化趋势符合图像________ (填序号)。 。
。________________ 。
 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备锂电池的正电极材料
等)为原料制备锂电池的正电极材料 的流程如图所示。
的流程如图所示。
(1)基态Mn原子价层电子排布式为
(2)“浸渣1”主要成分有
 和
和 的作用是
的作用是(3)“电解”中废液可循环用于
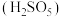 替代“电解”氧化
替代“电解”氧化 生成
生成 ,写出离子方程式:
,写出离子方程式:  第一步完全电离,第二步电离程度小)。
第一步完全电离,第二步电离程度小)。(4)在不同温度下,合成
 中的
中的 、
、 和
和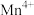 的含量与温度的关系如表所示:
的含量与温度的关系如表所示:
|
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |

 。
。
您最近一年使用:0次
名校
4 . 氯磺酸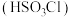 可用于制造农药、洗涤剂、塑料等,军事上常用于烟幕剂。实验室制备少量氯磺酸的装置如图所示(图中夹持、固定仪器等已略去)。
可用于制造农药、洗涤剂、塑料等,军事上常用于烟幕剂。实验室制备少量氯磺酸的装置如图所示(图中夹持、固定仪器等已略去)。 ,其中
,其中 由发烟硫酸提供。回答下列问题:
由发烟硫酸提供。回答下列问题:
(1)仪器甲的名称是__________ ,甲向乙中加入浓盐酸的第一步操作为__________ 。
(2)球形干燥管中装有__________ (填写试剂名称);若无此装置,氯磺酸发生反应的化学方程式为__________ 。
(3)装置B具有干燥气体、__________ 的作用。
(4)下列现象能说明装置丙中反应完成的是__________ (填标号)。
a.三颈烧瓶中液体出现分层
b.三颈烧瓶底部析出晶体
c.装置B、丙中进气口逸出的气泡速率相等,且丙中出现大量气泡
(5)当反应完成后,将装置C改为油浴蒸馏装置,分离氯磺酸时为防止其变质应持续加入的物质为__________ 。
(6)氯磺酸产品中可能含有少量 和
和 ,现测定其中总铁量,已知在pH为3~9时,邻菲啰啉能与
,现测定其中总铁量,已知在pH为3~9时,邻菲啰啉能与 形成橙色配合物Fe-phen,Fe-phen在
形成橙色配合物Fe-phen,Fe-phen在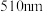 处的吸光度A与溶液中
处的吸光度A与溶液中 浓度呈线性关系,如下所示:
浓度呈线性关系,如下所示:
①测定实验步骤:取一定质量氯磺酸产品,加水水解为一定体积的强酸性溶液,加入 将
将 还原为
还原为 ,然后依次
,然后依次__________ (填写字母顺序)。
A.加入0..%邻菲啰啉溶液 B.加入缓冲溶液调节
C.摇匀、静置
②在一定条件下测定溶液的平均吸光度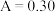 ,该产品中总铁量为
,该产品中总铁量为__________  (保留两位有效数字)。
(保留两位有效数字)。
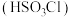 可用于制造农药、洗涤剂、塑料等,军事上常用于烟幕剂。实验室制备少量氯磺酸的装置如图所示(图中夹持、固定仪器等已略去)。
可用于制造农药、洗涤剂、塑料等,军事上常用于烟幕剂。实验室制备少量氯磺酸的装置如图所示(图中夹持、固定仪器等已略去)。
 ,其中
,其中 由发烟硫酸提供。回答下列问题:
由发烟硫酸提供。回答下列问题:(1)仪器甲的名称是
(2)球形干燥管中装有
(3)装置B具有干燥气体、
(4)下列现象能说明装置丙中反应完成的是
a.三颈烧瓶中液体出现分层
b.三颈烧瓶底部析出晶体
c.装置B、丙中进气口逸出的气泡速率相等,且丙中出现大量气泡
(5)当反应完成后,将装置C改为油浴蒸馏装置,分离氯磺酸时为防止其变质应持续加入的物质为
(6)氯磺酸产品中可能含有少量
 和
和 ,现测定其中总铁量,已知在pH为3~9时,邻菲啰啉能与
,现测定其中总铁量,已知在pH为3~9时,邻菲啰啉能与 形成橙色配合物Fe-phen,Fe-phen在
形成橙色配合物Fe-phen,Fe-phen在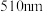 处的吸光度A与溶液中
处的吸光度A与溶液中 浓度呈线性关系,如下所示:
浓度呈线性关系,如下所示:
| 0 | 0.00080 | 0.0016 | 0.0024 | 0.0032 |
吸光度A | 0 | 0.20 | 0.40 | 0.60 | 0.80 |
 将
将 还原为
还原为 ,然后依次
,然后依次A.加入0..%邻菲啰啉溶液 B.加入缓冲溶液调节

C.摇匀、静置
②在一定条件下测定溶液的平均吸光度
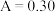 ,该产品中总铁量为
,该产品中总铁量为 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
5 . 硫酰氯( )是一种重要的化工试剂,被广泛应用于制造医药品、染料、表面活性剂等。某兴趣小组在实验室利用
)是一种重要的化工试剂,被广泛应用于制造医药品、染料、表面活性剂等。某兴趣小组在实验室利用 和
和 反应合成
反应合成 。
。
已知:① 。
。
② 的熔点为
的熔点为 ,沸点为
,沸点为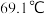 ;
; 以上会分解;遇水能发生剧烈反应,并产生白雾。
以上会分解;遇水能发生剧烈反应,并产生白雾。
回答下列问题:
(1)从甲~戊中选择合适的装置(可以重复选用)制备 ,正确的连接顺序是
,正确的连接顺序是
_______ 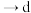 (用小写字母表示)。
(用小写字母表示)。_______ ;仪器Y中盛放的试剂为_______ (填名称),其作用为_______ 。
(3)装置丙中发生反应的离子方程式为_______ 。
(4)装置丁的作用有除去少量 气体、平衡气压和
气体、平衡气压和_______ 。
(5)硫酰氯纯度的测定:取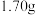 硫酰氯产品在密闭条件下溶于烧碱溶液,最后定容为
硫酰氯产品在密闭条件下溶于烧碱溶液,最后定容为 溶液,取
溶液,取 该溶液于锥形瓶中,调
该溶液于锥形瓶中,调 为
为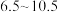 ,加入少量
,加入少量 作指示剂,用
作指示剂,用 的
的 标准溶液滴定(滴定过程中
标准溶液滴定(滴定过程中 不参与反应),平行滴定三次,平均消耗
不参与反应),平行滴定三次,平均消耗 标准溶液
标准溶液 。
。
①下列操作使测定结果偏低的是_______ (填字母)。
A.调节 过低
过低
B.滴定终点时,俯视标准液液面读数
C.锥形瓶未用待测液润洗
②该硫酰氯产品的纯度为_______ 。
(6)亚硫酰氯( )易水解,被广泛应用于结晶水合物的脱水。将
)易水解,被广泛应用于结晶水合物的脱水。将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
 )是一种重要的化工试剂,被广泛应用于制造医药品、染料、表面活性剂等。某兴趣小组在实验室利用
)是一种重要的化工试剂,被广泛应用于制造医药品、染料、表面活性剂等。某兴趣小组在实验室利用 和
和 反应合成
反应合成 。
。已知:①
 。
。②
 的熔点为
的熔点为 ,沸点为
,沸点为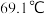 ;
; 以上会分解;遇水能发生剧烈反应,并产生白雾。
以上会分解;遇水能发生剧烈反应,并产生白雾。回答下列问题:
(1)从甲~戊中选择合适的装置(可以重复选用)制备
 ,正确的连接顺序是
,正确的连接顺序是
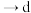 (用小写字母表示)。
(用小写字母表示)。
(3)装置丙中发生反应的离子方程式为
(4)装置丁的作用有除去少量
 气体、平衡气压和
气体、平衡气压和(5)硫酰氯纯度的测定:取
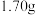 硫酰氯产品在密闭条件下溶于烧碱溶液,最后定容为
硫酰氯产品在密闭条件下溶于烧碱溶液,最后定容为 溶液,取
溶液,取 该溶液于锥形瓶中,调
该溶液于锥形瓶中,调 为
为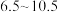 ,加入少量
,加入少量 作指示剂,用
作指示剂,用 的
的 标准溶液滴定(滴定过程中
标准溶液滴定(滴定过程中 不参与反应),平行滴定三次,平均消耗
不参与反应),平行滴定三次,平均消耗 标准溶液
标准溶液 。
。①下列操作使测定结果偏低的是
A.调节
 过低
过低B.滴定终点时,俯视标准液液面读数
C.锥形瓶未用待测液润洗
②该硫酰氯产品的纯度为
(6)亚硫酰氯(
 )易水解,被广泛应用于结晶水合物的脱水。将
)易水解,被广泛应用于结晶水合物的脱水。将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,写出该反应的化学方程式:
,写出该反应的化学方程式:
您最近一年使用:0次
7日内更新
|
97次组卷
|
3卷引用:2024届河南省安阳市高三下学期第三次模拟考试理科综合试题-高中化学
解题方法
6 . 肉桂酸钠(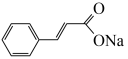 )是一种食品防腐剂,也是一种化妆品成分。某小组探究肉桂酸钠的性质。
)是一种食品防腐剂,也是一种化妆品成分。某小组探究肉桂酸钠的性质。
| 序号 | 操作 | 现象 |
 | 取适量肉桂酸钠溶于水中,滴加酚酞溶液 | 溶液变红色 |
 | 向酸性 溶液中滴加肉桂酸钠溶液,振荡 溶液中滴加肉桂酸钠溶液,振荡 | 溶液褪色 |
 | 向溴水中滴加肉桂酸钠溶液,振荡 | 溶液褪色 |
 可证明肉桂酸是
可证明肉桂酸是(2)由实验
 可知,肉桂酸钠具有
可知,肉桂酸钠具有 中发生反应的类型是
中发生反应的类型是实验(二):探究肉桂酸钠的水解(肉桂酸钠用NaR表示)。
(3)用肉桂酸钠固体配制
 溶液。
溶液。①下列仪器中,配制上述溶液不需要的是

(4)为了探究外界条件对NaR水解的影响,该小组设计如表所示实验:
| 序号 |  溶液/mL 溶液/mL | 蒸馏水/mL | 温度/℃ | 测定pH |
 | 10.0 | 0 | 25 | 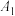 |
 | 5.0 | 5.0 | 25 | 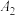 |
 | 10.0 | 0 | 45 |  |
 、
、 的目的是
的目的是②已知NaR水解为吸热反应,甲同学预测:
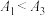 ,实验结果:
,实验结果: ,二者矛盾的主要原因是
,二者矛盾的主要原因是(5)该小组通过测定不同温度下NaR的水解常数
 ,确定温度对NaR水解程度的影响。
,确定温度对NaR水解程度的影响。【查阅资料】
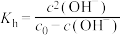 ,
, 为NaR溶液起始浓度。
为NaR溶液起始浓度。试剂和仪器:0.10 mol·L-1NaR溶液、0.100 0 mol·L-1盐酸、甲基橙溶液、pH计。
【设计实验】测定45℃下NaR的水解常数
 ,补充下表中实验。
,补充下表中实验。| 序号 | 实验 | 记录的数据 |
 | 取20.00mLNaR溶液,滴几滴甲基橙溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 盐酸体积为 |
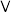 | 测定45℃纯水的pH |  |
 |  |
【实验处理】
45℃下,

【实验结论】Kh(65℃)>Kh(55℃)>Kh(45℃),升高温度,NaR水解程度增大。
您最近一年使用:0次
7 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠的工艺流程如图所示: 难溶于水。
难溶于水。
②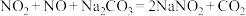 ,
,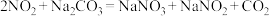 。
。
请回答下列问题:
(1)工业生产普通玻璃的主要原料有石英砂、______ 。
(2)“反应器”中需控制反应温度为:50∼60℃的原因是____________ 。
(3)假若Ni与浓硝酸反应产生的混合气体中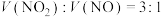 ,该反应的离子方程式为
,该反应的离子方程式为____________ 。
(4)为了除去 ,向“浸取液”中加入
,向“浸取液”中加入 调节pH至5~6。写出除去
调节pH至5~6。写出除去 并生成
并生成 的离子方程式:
的离子方程式:____________ 。
(5)补充完成操作③____________ 。
(6)向“转化器”中加入稀硝酸的目的是____________ 。
(7)若进入“吸收塔”的混合气体中NO为a mol、 为b mol、空气中含
为b mol、空气中含 为d mol,
为d mol, 溶液中含
溶液中含 为c mol,“转化器”中加入的稀硝酸中含e mol
为c mol,“转化器”中加入的稀硝酸中含e mol  ,则
,则
______ (用含e、d的代数式表示,不考虑流程中钠、氮元素的损失)。

 难溶于水。
难溶于水。②
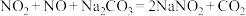 ,
,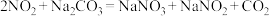 。
。请回答下列问题:
(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度为:50∼60℃的原因是
(3)假若Ni与浓硝酸反应产生的混合气体中
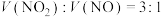 ,该反应的离子方程式为
,该反应的离子方程式为(4)为了除去
 ,向“浸取液”中加入
,向“浸取液”中加入 调节pH至5~6。写出除去
调节pH至5~6。写出除去 并生成
并生成 的离子方程式:
的离子方程式:(5)补充完成操作③
(6)向“转化器”中加入稀硝酸的目的是
(7)若进入“吸收塔”的混合气体中NO为a mol、
 为b mol、空气中含
为b mol、空气中含 为d mol,
为d mol, 溶液中含
溶液中含 为c mol,“转化器”中加入的稀硝酸中含e mol
为c mol,“转化器”中加入的稀硝酸中含e mol  ,则
,则
您最近一年使用:0次
8 . 五氯化锑(SbCl5)主要用作氟化工的催化剂、纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应 ,利用如下装置制备SbCl5 (加热及夹持装置略)。
,利用如下装置制备SbCl5 (加热及夹持装置略)。
实验室制备SbCl5的步骤如下:
ⅰ.保持80℃的条件,在盛有SbCl3的三颈烧瓶中通入Cl2,反应生成SbCl5;
ⅱ.将三颈烧瓶中的反应混合物转移到双颈烧瓶中;
ⅲ.减压蒸馏,收集目标物质。
回答下列问题:
(1)写出用K2MnO4和浓盐酸制备Cl2的离子方程式___________ ,其中体现还原性和酸性的HCl的物质的量之比为___________ 。
(2)实验装置中,两个冷凝管___________ (填“能”或“不能”)交换使用,步骤ⅰ中对三颈烧瓶进行加热的最佳方式是___________ 加热。
(3)写出图示实验装置存在的一处弊端:___________ 。
(4)步骤ⅱ将反应后混合液转移至双颈烧瓶中的方法:在b处连接减压装置,使三颈烧瓶中的液体流入双颈烧瓶。进行该操作前,需___________ (填活塞1和2的开、关的情况)。
(5)步骤ⅲ采用减压蒸馏,而不是常压蒸馏的原因是___________ ;调节减压装置至1.86kPa,收集___________ ℃左右的馏分。减压蒸馏时,玻璃毛细管的作用有___________ (填字母)。
a.防止暴沸 b.搅拌 c.连通大气,保持常压
 ,利用如下装置制备SbCl5 (加热及夹持装置略)。
,利用如下装置制备SbCl5 (加热及夹持装置略)。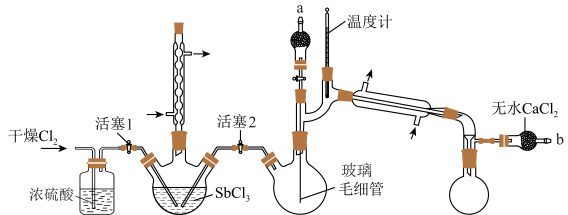
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| SbCl3 | 73.4 | 223(101.3kPa) | 均极易水解 |
| SbCl5 | 2.8 | 176(101.3kPa,140℃)时分解 | |
| 68(1.86kPa)、79(2.90kPa) |
ⅰ.保持80℃的条件,在盛有SbCl3的三颈烧瓶中通入Cl2,反应生成SbCl5;
ⅱ.将三颈烧瓶中的反应混合物转移到双颈烧瓶中;
ⅲ.减压蒸馏,收集目标物质。
回答下列问题:
(1)写出用K2MnO4和浓盐酸制备Cl2的离子方程式
(2)实验装置中,两个冷凝管
(3)写出图示实验装置存在的一处弊端:
(4)步骤ⅱ将反应后混合液转移至双颈烧瓶中的方法:在b处连接减压装置,使三颈烧瓶中的液体流入双颈烧瓶。进行该操作前,需
(5)步骤ⅲ采用减压蒸馏,而不是常压蒸馏的原因是
a.防止暴沸 b.搅拌 c.连通大气,保持常压
您最近一年使用:0次
2024-05-27更新
|
107次组卷
|
2卷引用:2024届陕西省西安市新城区高三下学期教学质量检测试题(三)理综能力测试-高中化学
名校
9 . 橡胶工业的硫化剂二氯化二硫( ,沸点:
,沸点: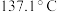 )是一种橙黄色液体,溶于
)是一种橙黄色液体,溶于 、
、 等,易水解,超过
等,易水解,超过 开始分解。可由
开始分解。可由 (沸点:
(沸点: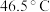 )与
)与 在
在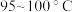 反应制备,同时有
反应制备,同时有 (沸点:
(沸点: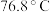 )生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):
)生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略): ;
; 在
在 以上分解生成
以上分解生成 和
和 。
。
回答下列问题:
(1)利用上述装置制备 ,按气流从左到右的方向连接各仪器接口,正确的顺序是a→
,按气流从左到右的方向连接各仪器接口,正确的顺序是a→____________ (填小写字母,仪器不重复使用)。
(2)装置 中生成
中生成 的化学方程式为
的化学方程式为________________________ 。
(3)仪器X的名称是____________________ ,试剂Y的名称是_______________ 。
(4)实验过程中仪器X中回流的主要物质是____________ (填化学式)。
(5)已知减压条件下可降低液体沸点。实验完成后,对E中混合液选择减压蒸馏,其原因是_________________ 。
(6)本实验对于装置E,需考虑的因素是____________ (任写一种即可)。
(7) 遇水水解时,产生能使品红溶液褪色的气体,写出
遇水水解时,产生能使品红溶液褪色的气体,写出 遇水反应的化学方程式:
遇水反应的化学方程式:_______________ 。
 ,沸点:
,沸点: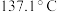 )是一种橙黄色液体,溶于
)是一种橙黄色液体,溶于 、
、 等,易水解,超过
等,易水解,超过 开始分解。可由
开始分解。可由 (沸点:
(沸点: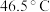 )与
)与 在
在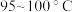 反应制备,同时有
反应制备,同时有 (沸点:
(沸点: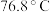 )生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):
)生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):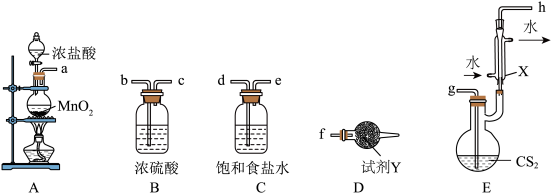
 ;
; 在
在 以上分解生成
以上分解生成 和
和 。
。回答下列问题:
(1)利用上述装置制备
 ,按气流从左到右的方向连接各仪器接口,正确的顺序是a→
,按气流从左到右的方向连接各仪器接口,正确的顺序是a→(2)装置
 中生成
中生成 的化学方程式为
的化学方程式为(3)仪器X的名称是
(4)实验过程中仪器X中回流的主要物质是
(5)已知减压条件下可降低液体沸点。实验完成后,对E中混合液选择减压蒸馏,其原因是
(6)本实验对于装置E,需考虑的因素是
(7)
 遇水水解时,产生能使品红溶液褪色的气体,写出
遇水水解时,产生能使品红溶液褪色的气体,写出 遇水反应的化学方程式:
遇水反应的化学方程式:
您最近一年使用:0次
2024-05-26更新
|
64次组卷
|
2卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
10 . 某学习小组对“ 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:
(1)如图所示将浸泡过 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。 溶液的操作为先加
溶液的操作为先加____________ 溶解 ,再稀释至所需浓度。
,再稀释至所需浓度。
②用化学方程式解释粉笔表面出现红褐色的原因:________________ 。
③溶液变铁锈色是因为生成了______________ (填化学式)。
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料: 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。
提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为________________ ,未呈现黑色。
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是_______________ 。
限选试剂:黑色粉末样品、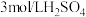 溶液、
溶液、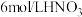 溶液、
溶液、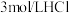 溶液、
溶液、 酸性
酸性 溶液、
溶液、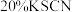 溶液、蒸馏水。
溶液、蒸馏水。
(4)由以上实验测得黑色粉末中铁元素的质量分数为_______________ (已知实验条件下所得 固体中
固体中 与
与 个数比为
个数比为 )。
)。
 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:(1)如图所示将浸泡过
 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。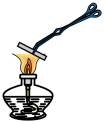
 溶液的操作为先加
溶液的操作为先加 ,再稀释至所需浓度。
,再稀释至所需浓度。②用化学方程式解释粉笔表面出现红褐色的原因:
③溶液变铁锈色是因为生成了
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料:
 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热
 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
限选试剂:黑色粉末样品、
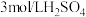 溶液、
溶液、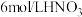 溶液、
溶液、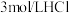 溶液、
溶液、 酸性
酸性 溶液、
溶液、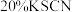 溶液、蒸馏水。
溶液、蒸馏水。实验序号 | 实验操作 | 实验现象 | 实验结论 |
| 3 | 取黑色粉末靠近磁铁 | 黑色粉末几乎全被磁铁吸引,未被吸收的黑色粉末经检验不含铁元素 | 黑色粉末不是 |
| 4 | 向盛有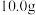 黑色粉末的试管中加入① 黑色粉末的试管中加入① | 固体全部溶解且无气泡产生 | ② |
| 5 | 将实验4的溶液分为四等份,用 酸性 酸性 溶液滴定至终点,重复三次平均消耗 溶液滴定至终点,重复三次平均消耗 溶液 溶液 | 滴定终点现象是 ③ | 黑色粉末是 |
| 6 | 取实验5中剩余一等份溶液于洁净试管中,加入④ | ⑤ |
(4)由以上实验测得黑色粉末中铁元素的质量分数为
 固体中
固体中 与
与 个数比为
个数比为 )。
)。
您最近一年使用:0次
2024-05-24更新
|
97次组卷
|
2卷引用:2024届浙江省高三下学期5月份大联考化学试题