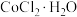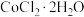名校
解题方法
1 . 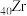 与
与 同族,
同族, 有3种常见晶胞结构,最为常见的是立方
有3种常见晶胞结构,最为常见的是立方 (晶胞为立方体)、四方
(晶胞为立方体)、四方 (晶胞为长方体,其底面为正方形),立方
(晶胞为长方体,其底面为正方形),立方 性质与钻石接近,可加工为璀璨夺目的饰品。
性质与钻石接近,可加工为璀璨夺目的饰品。___________ 。
(2)将氧氯化锆 配制成物质的量浓度为
配制成物质的量浓度为 的溶液,持续煮沸50小时后过滤,即可得到粉末状的
的溶液,持续煮沸50小时后过滤,即可得到粉末状的 ,制备
,制备 的化学方程式
的化学方程式___________ 。
(3)上图所示立方 的晶胞中,位于顶点的原子是
的晶胞中,位于顶点的原子是___________ 。
(4)上图所示四方 的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为
的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为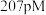 或
或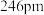 ,其余Zr原子距离明显远于
,其余Zr原子距离明显远于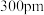 ,距离每个O原子“最近”的Zr原子共
,距离每个O原子“最近”的Zr原子共___________ 个。
(5)四方 升温至2370℃时转化为立方
升温至2370℃时转化为立方 ,两种晶体中Zr原子间最近距离均为
,两种晶体中Zr原子间最近距离均为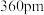 ,则四方
,则四方 转化为立方
转化为立方 时,密度
时,密度___________ (填“增大”“不变”或“减小”)。两种晶体中,密度较大的晶体的密度计算式为___________ 。(列出计算式即可。以 表示阿伏加德罗常数的值。)
表示阿伏加德罗常数的值。)
 与
与 同族,
同族, 有3种常见晶胞结构,最为常见的是立方
有3种常见晶胞结构,最为常见的是立方 (晶胞为立方体)、四方
(晶胞为立方体)、四方 (晶胞为长方体,其底面为正方形),立方
(晶胞为长方体,其底面为正方形),立方 性质与钻石接近,可加工为璀璨夺目的饰品。
性质与钻石接近,可加工为璀璨夺目的饰品。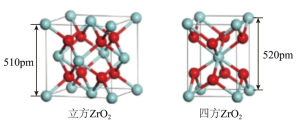
(2)将氧氯化锆
 配制成物质的量浓度为
配制成物质的量浓度为 的溶液,持续煮沸50小时后过滤,即可得到粉末状的
的溶液,持续煮沸50小时后过滤,即可得到粉末状的 ,制备
,制备 的化学方程式
的化学方程式(3)上图所示立方
 的晶胞中,位于顶点的原子是
的晶胞中,位于顶点的原子是(4)上图所示四方
 的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为
的晶胞中,每个O原子周围,距离“最近”的Zr原子与其距离为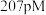 或
或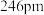 ,其余Zr原子距离明显远于
,其余Zr原子距离明显远于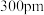 ,距离每个O原子“最近”的Zr原子共
,距离每个O原子“最近”的Zr原子共(5)四方
 升温至2370℃时转化为立方
升温至2370℃时转化为立方 ,两种晶体中Zr原子间最近距离均为
,两种晶体中Zr原子间最近距离均为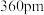 ,则四方
,则四方 转化为立方
转化为立方 时,密度
时,密度 表示阿伏加德罗常数的值。)
表示阿伏加德罗常数的值。)
您最近一年使用:0次
2 . 钴盐在生活和生产中有着重要应用。
(1)干燥剂变色硅胶常含有 。常见氯化钴晶体的颜色如下:
。常见氯化钴晶体的颜色如下:
变色硅胶吸水饱和后颜色变成__________ ,硅胶中添加 的作用
的作用__________ 。
(2)草酸钴是制备钴氧化物的重要原料,常用 溶液和
溶液和 溶液制取难溶于水的
溶液制取难溶于水的 晶体。
晶体。
①常温下, 溶液的
溶液的
__________ 7(填“>”“=”或“<”)。(已知:常温下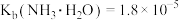 ,
, ,
,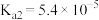 。)
。)
②制取 晶体时,还需加入适量氨水,其作用是
晶体时,还需加入适量氨水,其作用是__________ 。
③在空气中加热 二水合草酸钴
二水合草酸钴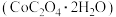 ,受热过程中在不同温度范围内分别得到一种固体物质。已知
,受热过程中在不同温度范围内分别得到一种固体物质。已知 的两种常见化合价为
的两种常见化合价为 价和
价和 价,
价,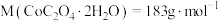 。
。
ⅰ.温度在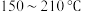 范围内,固体物质为
范围内,固体物质为__________ (填化学式,下同);
ⅱ.从 加热到
加热到 时生成一种钴的氧化物和
时生成一种钴的氧化物和 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是__________ 。
(1)干燥剂变色硅胶常含有
 。常见氯化钴晶体的颜色如下:
。常见氯化钴晶体的颜色如下:化学式 |
|
|
|
|
颜色 | 蓝色 | 蓝紫色 | 紫红色 | 粉红色 |
变色硅胶吸水饱和后颜色变成
 的作用
的作用(2)草酸钴是制备钴氧化物的重要原料,常用
 溶液和
溶液和 溶液制取难溶于水的
溶液制取难溶于水的 晶体。
晶体。①常温下,
 溶液的
溶液的
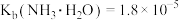 ,
, ,
,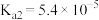 。)
。)②制取
 晶体时,还需加入适量氨水,其作用是
晶体时,还需加入适量氨水,其作用是③在空气中加热
 二水合草酸钴
二水合草酸钴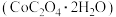 ,受热过程中在不同温度范围内分别得到一种固体物质。已知
,受热过程中在不同温度范围内分别得到一种固体物质。已知 的两种常见化合价为
的两种常见化合价为 价和
价和 价,
价,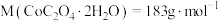 。
。温度范围/ | 150~210 | 290~320 |
固体质量/g | 8.82 | 4.82 |
ⅰ.温度在
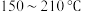 范围内,固体物质为
范围内,固体物质为ⅱ.从
 加热到
加热到 时生成一种钴的氧化物和
时生成一种钴的氧化物和 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是
您最近一年使用:0次
解题方法
3 . 铜及其化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)纳米铜是性能优异的超导材料,工业上以辉铜矿(主要成分为 )为原料制备纳米铜粉,
)为原料制备纳米铜粉, 中铜元素的化合价为
中铜元素的化合价为_______ 价。
(2)无水 常用于检验物质中是否含有水,吸水后会形成
常用于检验物质中是否含有水,吸水后会形成_______ 色晶体,俗称_______ 。
(3) 的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为
的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为_______ 。
(4) 常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成
常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成 ,
, 对该反应有催化作用,其催化原理如图所示。
对该反应有催化作用,其催化原理如图所示。 的化学式为
的化学式为_______ 。

(5)CuCl广泛应用于化工和印染等行业。在高于300℃,HCl气流中热分解 可以制备CuCl,其中HCl的作用是
可以制备CuCl,其中HCl的作用是_______ 。
(1)纳米铜是性能优异的超导材料,工业上以辉铜矿(主要成分为
 )为原料制备纳米铜粉,
)为原料制备纳米铜粉, 中铜元素的化合价为
中铜元素的化合价为(2)无水
 常用于检验物质中是否含有水,吸水后会形成
常用于检验物质中是否含有水,吸水后会形成(3)
 的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为
的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为(4)
 常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成
常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成 ,
, 对该反应有催化作用,其催化原理如图所示。
对该反应有催化作用,其催化原理如图所示。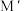 的化学式为
的化学式为
(5)CuCl广泛应用于化工和印染等行业。在高于300℃,HCl气流中热分解
 可以制备CuCl,其中HCl的作用是
可以制备CuCl,其中HCl的作用是
您最近一年使用:0次
4 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____ 、____ 、____ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:____ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:____ 。
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+____ Br- (填“>”或“<”)。
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈____ 色,写出该反应的离子方程式____ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近一年使用:0次
解题方法
5 . 中国“神舟”飞船举世瞩目,请完成下列填空:
(1)已知1g火箭推进剂肼(N2H4)(g)燃烧生成N2(g)和H2O(g)时,放出16.7kJ的热量,请写出该反应的热化学方程式_______ 。
(2)飞船材料采用的某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):
采用碱腐蚀工艺,用稀NaOH 溶液在40-55℃下进行表面处理0.5-2 min,以便形成致密氧化膜提高耐腐蚀性能。请写出碱腐蚀过程中一个主要反应的化学方程式_______ 。工业上制铝,可采用电解_______ (请选填序号):
A.AlCl3 B.Al2O3 C.NaAlO2
同时需添加_______ 以降低熔点减少能量损耗。
(3)太空舱中宇航员可利用呼出的二氧化碳与过氧化钠作用来获得氧气,反应方程式为2Na2O2+2CO2→2Na2CO3+O2,其中还原产物为_______ ,当转移1mol电子时,生成标准状况下O2_______ L。
(4)飞船返回时,反推发动机的燃料中含铝粉,若回收地点附近水中Al3+浓度超标,可喷洒碳酸氢钠减少污染,请结合平衡移动规律解释该措施_______ 。
(1)已知1g火箭推进剂肼(N2H4)(g)燃烧生成N2(g)和H2O(g)时,放出16.7kJ的热量,请写出该反应的热化学方程式
(2)飞船材料采用的某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):
| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9-3.5 | 0.5 | 0.25-0.8 | 0.25 | 0.1 | 0.8-1.1 | Bal |
采用碱腐蚀工艺,用稀NaOH 溶液在40-55℃下进行表面处理0.5-2 min,以便形成致密氧化膜提高耐腐蚀性能。请写出碱腐蚀过程中一个主要反应的化学方程式
A.AlCl3 B.Al2O3 C.NaAlO2
同时需添加
(3)太空舱中宇航员可利用呼出的二氧化碳与过氧化钠作用来获得氧气,反应方程式为2Na2O2+2CO2→2Na2CO3+O2,其中还原产物为
(4)飞船返回时,反推发动机的燃料中含铝粉,若回收地点附近水中Al3+浓度超标,可喷洒碳酸氢钠减少污染,请结合平衡移动规律解释该措施
您最近一年使用:0次
6 . 回答下列问题:
(1)已知固态NH3、H2O、HF中的氢键的键能和结构示意图如表所示:

H2O、HF、NH3沸点依次降低的原因是____ 。
(2)已知:常温时H2A的Ka1=5×10-5,Ka2=3×10-9,请判断NaHA溶液的酸碱性并说明原因:____ 。
(1)已知固态NH3、H2O、HF中的氢键的键能和结构示意图如表所示:
| 物质及其氢键 | HF(s):F—H…F | H2O(s):O—H…O | NH3(s):N—H…N |
| 键能/(kJ·mol-1) | 28.1 | 18.8 | 5.4 |

H2O、HF、NH3沸点依次降低的原因是
(2)已知:常温时H2A的Ka1=5×10-5,Ka2=3×10-9,请判断NaHA溶液的酸碱性并说明原因:
您最近一年使用:0次
7 . 电镀废液中含有Cu2+、Mg2+、Ca2+、Ni2+和Fe3+,某专利申请用下列方法从该类废液中制备高纯度的铜粉。

已知导体和其接触的溶液的界面上会形成一定的电位差,被称作电极电位。如反应Cu2+(氧化态)+2e-=Cu(还原态)的标准电极电位表示为Cu2+/Cu=0.34,该值越大氧化态的氧化性越强,越小还原态的还原性越强。两个电对间的电极电位差别越大,二者之间的氧化还原反应越易发生。某些电对的电极电位如下表所示:
回答下列问题:
(1)蒸发浓缩后的溶液中,Cu2+的物质的量浓度≥_______ (结果保留两位小数)。分离固液混合物时,需要用真空抽滤的方法提高过滤的速度和效果,其原因是_______ 。
(2)溶液的氧化还原电位越高,其氧化能力同样越强。溶液的氧化还原电位,与溶液中离子等微粒的种类及其浓度相关,实验测得Cu2+与SO2反应体系的氧化还原电位与铜粉的回收率和纯度的关系如下表所示:
①由此可知,制备过程中进行电位检测时,要把溶液的氧化还原电位控制在_______ mV左右。
②专利申请书指出,反应液的反应历程为Cu2+首先被还原为Cu+,Cu+再歧化为Cu和Cu2+。反应历程不是Cu2+直接被还原为Cu的原因是_______ 。反应生成Cu+的离子方程式是_______ 。
(3)废液2中含有的金属离子除Mg2+、Ca2+外还有_______ 。为了使这些离子均除去,使水得到进一步的净化,应该在调节溶液pH使其他杂质离子沉淀后,再使Ca2+转化为_______ (填化学式)而除去。

已知导体和其接触的溶液的界面上会形成一定的电位差,被称作电极电位。如反应Cu2+(氧化态)+2e-=Cu(还原态)的标准电极电位表示为Cu2+/Cu=0.34,该值越大氧化态的氧化性越强,越小还原态的还原性越强。两个电对间的电极电位差别越大,二者之间的氧化还原反应越易发生。某些电对的电极电位如下表所示:
| Fe3+/Fe2+ | Cu2+/Cu+ | Cu2+/Cu |  /SO2 /SO2 | Fe2+/Fe | Ni2+/Ni | Mg2+/Mg | Ca2+/Ca |
| 0.77 | 0.52 | 0.34 | 0.17 | -0.44 | -0.23 | -2.38 | -2.76 |
(1)蒸发浓缩后的溶液中,Cu2+的物质的量浓度≥
(2)溶液的氧化还原电位越高,其氧化能力同样越强。溶液的氧化还原电位,与溶液中离子等微粒的种类及其浓度相关,实验测得Cu2+与SO2反应体系的氧化还原电位与铜粉的回收率和纯度的关系如下表所示:
| 反应液的电位(mV) | 360 | 340 | 320 | 300 | 280 | 260 |
| 铜粉的回收率(%) | 86.5 | 90.2 | 95.6 | 97.2 | 97.3 | 97.4 |
| 产品的纯度(%) | 99.9 | 99.9 | 99.9 | 99.9 | 99.9 | 99.9 |
②专利申请书指出,反应液的反应历程为Cu2+首先被还原为Cu+,Cu+再歧化为Cu和Cu2+。反应历程不是Cu2+直接被还原为Cu的原因是
(3)废液2中含有的金属离子除Mg2+、Ca2+外还有
您最近一年使用:0次
8 . 铬是人体必须的微量元素,在人体代谢中发挥着特殊作用。回答下列问题:
(1)金属铬可以通过焦炭高温还原铬铁矿(FeCr2O4)制取,同时生成一种有毒的气体,该反应的化学方程式为______ 。
(2)①取冶炼所得的金属铬溶解在盐酸中制取CrCl3溶液,其中混有FeCl2杂质,请完成除杂方案:向溶液中加入足量NaOH溶液,过滤,向滤液中______ ,过滤,将固体溶解在稀盐酸中(已知Cr(OH)3是两性氢氧化物)。
②由CrCl3溶液得到CrCl3•6H2O,除去其结晶水的操作是______ 。
(3)Cr3+在碱性条件下易被氧化成CrO ,写出向CrCl3溶液中加入氨水和过氧化氢发生反应的离子方程式
,写出向CrCl3溶液中加入氨水和过氧化氢发生反应的离子方程式______ 。
(4)CrO 在酸性条件下可转化为Cr2O
在酸性条件下可转化为Cr2O ,Cr2O
,Cr2O 可以用来检验H2O2,原理是Cr2O
可以用来检验H2O2,原理是Cr2O +4H2O2+2H+
+4H2O2+2H+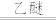 2CrO5(蓝色)+5H2O。
2CrO5(蓝色)+5H2O。
①CrO5中铬元素为+6价,其中过氧键的数目为______ 。
②酸化重铬酸钾选用的酸为______ (填标号)。
a.稀盐酸 b.稀硫酸 c.氢碘酸 d.磷酸
(1)金属铬可以通过焦炭高温还原铬铁矿(FeCr2O4)制取,同时生成一种有毒的气体,该反应的化学方程式为
(2)①取冶炼所得的金属铬溶解在盐酸中制取CrCl3溶液,其中混有FeCl2杂质,请完成除杂方案:向溶液中加入足量NaOH溶液,过滤,向滤液中
②由CrCl3溶液得到CrCl3•6H2O,除去其结晶水的操作是
(3)Cr3+在碱性条件下易被氧化成CrO
 ,写出向CrCl3溶液中加入氨水和过氧化氢发生反应的离子方程式
,写出向CrCl3溶液中加入氨水和过氧化氢发生反应的离子方程式(4)CrO
 在酸性条件下可转化为Cr2O
在酸性条件下可转化为Cr2O ,Cr2O
,Cr2O 可以用来检验H2O2,原理是Cr2O
可以用来检验H2O2,原理是Cr2O +4H2O2+2H+
+4H2O2+2H+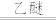 2CrO5(蓝色)+5H2O。
2CrO5(蓝色)+5H2O。①CrO5中铬元素为+6价,其中过氧键的数目为
②酸化重铬酸钾选用的酸为
a.稀盐酸 b.稀硫酸 c.氢碘酸 d.磷酸
您最近一年使用:0次
9 . 神舟十二号飞船携带3名航天员返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵(NH4ClO4)和铝粉混合物。
完成下列填空:
(1)上述燃料涉及的元素所形成的简单离子中,核外电子数相同的离子半径由大到小顺序为___________ (离子符号表示),上述元素的原子中,未成对电子数最多的核外电子排布式为___________ 。
(2)写出NH 的电子式
的电子式___________ ,其空间构型与甲烷空间构型相同,为___________ 型。
(3)氮气性质比较稳定,从分子结构的角度说明理由。___________
(4)配平以下方程式:___________
_____Al+_____NH4ClO4→______Al2O3+_____AlCl3+_____N2↑+____ H2O 。
上述反应中被氧化的元素是___________ ,若产生42g氮气,过程中氮元素转移电子为___________ mol。
(5)若回收地点附近的水中Al3+浓度超标,加入碳酸氢钠,可有效降低Al3+浓度,减少了水污染,请说明理由___________
完成下列填空:
(1)上述燃料涉及的元素所形成的简单离子中,核外电子数相同的离子半径由大到小顺序为
(2)写出NH
 的电子式
的电子式(3)氮气性质比较稳定,从分子结构的角度说明理由。
(4)配平以下方程式:
_____Al+_____NH4ClO4→______Al2O3+_____AlCl3+_____N2↑+____ H2O 。
上述反应中被氧化的元素是
(5)若回收地点附近的水中Al3+浓度超标,加入碳酸氢钠,可有效降低Al3+浓度,减少了水污染,请说明理由
您最近一年使用:0次
10 . 已知:H2A的Ka1=1.0×10-6,Ka2=1.0×10-11;H2B的Ka1=5.6×10-8,Ka2=1.2×10-15。
(1)写出向Na2A溶液中通入少量H2B气体发生反应的离子方程式:__ 。
(2)NaHA溶液呈__ (填“酸性”、“碱性”或“中性”),通过计算说明判断依据:__ 。
(1)写出向Na2A溶液中通入少量H2B气体发生反应的离子方程式:
(2)NaHA溶液呈
您最近一年使用:0次