1 . 下列说法正确的是
| A.加热氯化钠溶液,pH值将变小 |
B.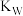 随着溶液中 随着溶液中 和 和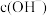 的改变而改变 的改变而改变 |
C.所有的盐类都可以发生水解,水解程度越大 越大 越大 |
D.一般情况下,一元弱碱的 值越大碱性越弱 值越大碱性越弱 |
您最近一年使用:0次
2021-11-05更新
|
210次组卷
|
2卷引用:辽宁省沈阳市郊联体2021-2022学年高二上学期期中考试化学试题
名校
解题方法
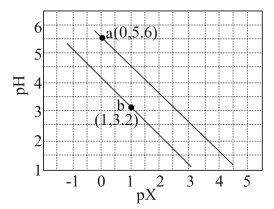
2 . 常温下,用NaOH溶液滴定二元弱酸H2A,混合溶液的pH与pX的关系如图所示。pX代表 或
或 。下列有关说法错误的是
。下列有关说法错误的是
 或
或 。下列有关说法错误的是
。下列有关说法错误的是
A.H2A溶液中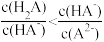 |
B.H2A的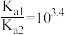 |
| C.a点、b点溶液中均有c(Na+) <2c(A2-)+c(HA-) |
| D.恰好完全中和时,c(OH-) =c(HA-) +2c(H2A) +c(H+) |
您最近一年使用:0次
3 . 室温下,下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液 | 溶液变红色 | 待测液中含有 |
| B | 向浓度均为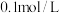 的 的 和 和 混合溶液中滴加 混合溶液中滴加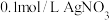 溶液 溶液 | 先出现黄色沉淀 |  还原性强于 还原性强于 |
| C | 将稀 滴加到饱和 滴加到饱和 溶液中,将产生的气体通入 溶液中,将产生的气体通入 溶液 溶液 | 紫色溶液褪去 | 产生的气体具有漂白性 |
| D | 用pH计测量相同浓度NaClO溶液和 溶液的pH值 溶液的pH值 | NaClO溶液的pH值大于 溶液 溶液 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 将标准状况下的22.4L SO2通入4mol NaOH溶液中,下列用来解释事实的方程式中不合理的是(已知室温下饱和Na2SO3溶液的pH约为8.3)
A.标准状况下的22.4L SO2通入含4mol NaOH的溶液:2OH-+SO2=SO +H2O +H2O |
B.上述反应后所得溶液的pH约为12:SO +H2O +H2O HSO HSO +OH- +OH- |
C.向上述反应后所得溶液中,通入氯气,pH下降:SO +Cl2+2OH-=SO +Cl2+2OH-=SO +2Cl-+H2O +2Cl-+H2O |
D.向上述反应后所得溶液中,滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO +Ba2++H2O2=BaSO4↓+H2O +Ba2++H2O2=BaSO4↓+H2O |
您最近一年使用:0次
2023-04-21更新
|
249次组卷
|
2卷引用:北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
名校
5 .  相同的以下溶液:①
相同的以下溶液:① ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ 溶液中,溶质物质的量浓度大小比较,正确的顺序是
溶液中,溶质物质的量浓度大小比较,正确的顺序是
 相同的以下溶液:①
相同的以下溶液:① ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ 溶液中,溶质物质的量浓度大小比较,正确的顺序是
溶液中,溶质物质的量浓度大小比较,正确的顺序是| A.⑤>④>①>②>③ | B.②>③>①>④>⑤ |
| C.④>⑤>②>③>① | D.③>②>①>④>⑤ |
您最近一年使用:0次
名校
6 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.18 g H218O含有的中子数为10NA |
| B.1 L 1.0 mol/L的碳酸钠溶液含有阴离子总数大于NA |
| C.2 mol NO与1molO2在密闭容器中充分反应后的分子数为2NA |
| D.23 g Na与足量H2O反应生成的H2分子数目为NA |
您最近一年使用:0次
解题方法
7 . 我国是少数几个拥有石煤资源的国家之一,工业上以伴生钒的石煤(主要成分为 ,含少量
,含少量 、
、 等杂质)为原料制备钒的主要流程如下:
等杂质)为原料制备钒的主要流程如下:

已知:① 难溶于水。②
难溶于水。②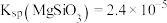 ,
,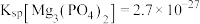 。③相对原子质量:
。③相对原子质量: 。
。
请回答下列问题:
(1)焙烧:通入空气的条件下,向石煤中加纯碱焙烧,将 转化为
转化为 的化学方程式为
的化学方程式为______ 。
(2)除硅、磷;用 溶液除硅、磷时,Si、P会形成
溶液除硅、磷时,Si、P会形成 、
、 沉淀。若沉淀后溶液中
沉淀。若沉淀后溶液中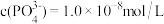 ,则
,则
______ 。随着温度升高,除磷率会显著下降,原因一是温度升高, 溶解度增大;二是
溶解度增大;二是______ 。
(3)沉钒:该操作产生的滤液中,两种主要的溶质阴离子是______ (写符号);检验该滤液中其立体构型为正四面体形的阴离子方法是______ 。
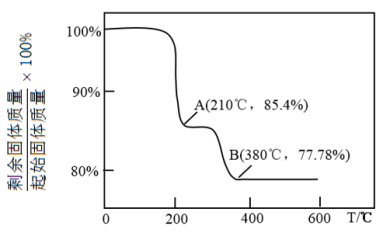
(4)灼烧:在灼烧 的过程中有
的过程中有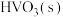 及气体物质生成,固体残留率随温度变化的曲线如图所示,则0℃~210℃,发生反应的化学方程式为
及气体物质生成,固体残留率随温度变化的曲线如图所示,则0℃~210℃,发生反应的化学方程式为______ 。
(5)还原:在高温真空条件下,用过量焦炭还原 可以生成钒单质,该反应的化学方程式为
可以生成钒单质,该反应的化学方程式为______ 。
 ,含少量
,含少量 、
、 等杂质)为原料制备钒的主要流程如下:
等杂质)为原料制备钒的主要流程如下:
已知:①
 难溶于水。②
难溶于水。②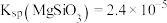 ,
,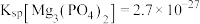 。③相对原子质量:
。③相对原子质量: 。
。请回答下列问题:
(1)焙烧:通入空气的条件下,向石煤中加纯碱焙烧,将
 转化为
转化为 的化学方程式为
的化学方程式为(2)除硅、磷;用
 溶液除硅、磷时,Si、P会形成
溶液除硅、磷时,Si、P会形成 、
、 沉淀。若沉淀后溶液中
沉淀。若沉淀后溶液中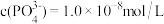 ,则
,则
 溶解度增大;二是
溶解度增大;二是(3)沉钒:该操作产生的滤液中,两种主要的溶质阴离子是
(4)灼烧:在灼烧
 的过程中有
的过程中有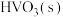 及气体物质生成,固体残留率随温度变化的曲线如图所示,则0℃~210℃,发生反应的化学方程式为
及气体物质生成,固体残留率随温度变化的曲线如图所示,则0℃~210℃,发生反应的化学方程式为
(5)还原:在高温真空条件下,用过量焦炭还原
 可以生成钒单质,该反应的化学方程式为
可以生成钒单质,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . I.二氯亚砜(SOCl2)是一种无色发烟液体,熔点-105℃,沸点 79℃,140℃以上时易分解,遇水剧烈水解。
(1)在约70℃时,某化学兴趣小组拟用下图装置实现 ZnCl2·xH2O晶体脱水制取无水ZnCl2并回收二氯亚砜。
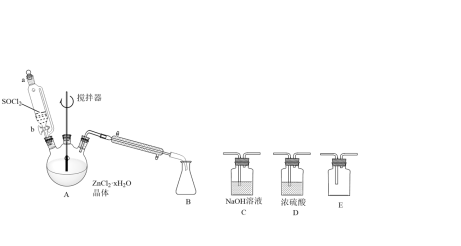
①A装置中的分液漏斗与普通分液漏斗比较,优点是___________ 。
②为防止污染环境,装置B后的连接下列C、D、E,顺序为____ 。
(2)该兴趣小组经过反复实验探究得知,将等浓度、等体积的ZnCl2溶液和Na2CO3液合理混合可以得到化工原料碳酸锌。已知锌离子向氢氧化物转化时,开始沉淀和沉淀完全pH分别为5.54和9.54,则制备ZnCO3时,选用的加料方式是____ (填字母,溶液中Zn2+浓度按1.0 mol/L计算)。
A.将ZnCl2溶液和Na2CO3溶液同时加入到反应器中,不断搅拌
B.将ZnCl2溶液缓慢加入到盛有Na2CO3溶液的反应器中,不断搅拌
C.将Na2CO3溶液缓慢加入到盛有ZnCl2溶液的反应器中,不断搅拌
II.该化学兴趣小组采用归类对比探究的学习方法。查知:二氯砜(SO2Cl2)是一种无色发烟液体;69.1℃时沸腾,同时会有分解,100℃以上分解剧烈;遇水剧烈水解。
该小组拟用干燥的Cl2和SO2在活性炭催化下制取二氯砜。
反应的化学方程式为:SO2(g)+Cl2(g)=SO2Cl2(l) △H=-97.3 kJ·mol-1
实验装置如图所示(部分夹持装置未画出)。
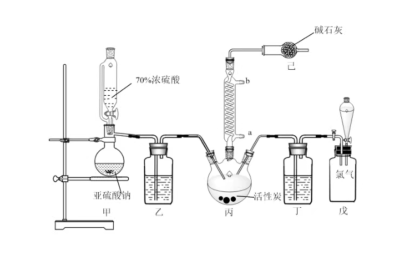
(3)装置己的作用是___________ ;
(4)装置戊上方分液漏斗中最好选用___________ 溶液。
(5)如何控制两种反应气的输入体积大致相等?___________ 。
(6)氯磺酸(ClSO3H)加热分解,也能制得二氯砜:2ClSO3H SO2Cl2+H2SO4,已知该反应中两种产物互溶,分离这两种产物的方法是
SO2Cl2+H2SO4,已知该反应中两种产物互溶,分离这两种产物的方法是___________ 。
(1)在约70℃时,某化学兴趣小组拟用下图装置实现 ZnCl2·xH2O晶体脱水制取无水ZnCl2并回收二氯亚砜。

①A装置中的分液漏斗与普通分液漏斗比较,优点是
②为防止污染环境,装置B后的连接下列C、D、E,顺序为
(2)该兴趣小组经过反复实验探究得知,将等浓度、等体积的ZnCl2溶液和Na2CO3液合理混合可以得到化工原料碳酸锌。已知锌离子向氢氧化物转化时,开始沉淀和沉淀完全pH分别为5.54和9.54,则制备ZnCO3时,选用的加料方式是
A.将ZnCl2溶液和Na2CO3溶液同时加入到反应器中,不断搅拌
B.将ZnCl2溶液缓慢加入到盛有Na2CO3溶液的反应器中,不断搅拌
C.将Na2CO3溶液缓慢加入到盛有ZnCl2溶液的反应器中,不断搅拌
II.该化学兴趣小组采用归类对比探究的学习方法。查知:二氯砜(SO2Cl2)是一种无色发烟液体;69.1℃时沸腾,同时会有分解,100℃以上分解剧烈;遇水剧烈水解。
该小组拟用干燥的Cl2和SO2在活性炭催化下制取二氯砜。
反应的化学方程式为:SO2(g)+Cl2(g)=SO2Cl2(l) △H=-97.3 kJ·mol-1
实验装置如图所示(部分夹持装置未画出)。

(3)装置己的作用是
(4)装置戊上方分液漏斗中最好选用
(5)如何控制两种反应气的输入体积大致相等?
(6)氯磺酸(ClSO3H)加热分解,也能制得二氯砜:2ClSO3H
 SO2Cl2+H2SO4,已知该反应中两种产物互溶,分离这两种产物的方法是
SO2Cl2+H2SO4,已知该反应中两种产物互溶,分离这两种产物的方法是
您最近一年使用:0次
9 . 下列措施,一定能使NaCl溶液中 减小的是
减小的是
 减小的是
减小的是A.加热使 大 大 | B.投入一小块金属钠 |
C.加入少量 固体 固体 | D.以石墨为电极进行电解 |
您最近一年使用:0次
名校
10 . NA代表阿伏加德罗常数的值。下列说法正确的是
| A.3.9gNa2O2晶体中阴离子的数目为0.1NA |
| B.100mL1mol•L−1FeCl3溶液中所含Fe3+的数目为0.1NA |
| C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA |
| D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA |
您最近一年使用:0次
2021-10-21更新
|
127次组卷
|
2卷引用:辽宁省朝阳育英高考补习学校2022届高三10月月考化学试题



