名校
1 . 废旧锌锰电池中的黑锰粉含有 、
、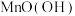 、
、 和少量
和少量 、
、 及炭黑等,为了保护环境、充分利用锰资源,通过如图流程制备
及炭黑等,为了保护环境、充分利用锰资源,通过如图流程制备 。
。
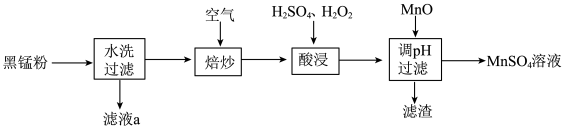
回答下列问题:
(1)“滤液a”的主要成分为 ,另外还含有少量
,另外还含有少量 等。
等。
①用离子方程式表示“滤液a“呈酸性的原因:______ 。
②根据如图所示的溶解度曲线,将“滤液a”______ 、洗涤、干燥,得 固体。
固体。

(2)“熔炒”的目的是除炭、氧化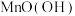 等。空气中
等。空气中 氧化
氧化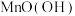 的化学方程式为
的化学方程式为______ 。
(3)探究“酸浸”中 溶解的适宜操作。
溶解的适宜操作。
实验Ⅰ.向 中加入
中加入 溶液,产生大量气泡;再加入稀
溶液,产生大量气泡;再加入稀 ,固体未明显溶解。
,固体未明显溶解。
实验Ⅱ.向 中加入稀
中加入稀 ,固体未溶解;再加入
,固体未溶解;再加入 溶液,产生大量气泡,固体完全溶解。
溶液,产生大量气泡,固体完全溶解。
实验Ⅰ中 的作用是
的作用是____ ,实验Ⅱ中 的作用是
的作用是______ 。
(4)证明 溶液中
溶液中 沉淀完全:取少量溶液,滴加
沉淀完全:取少量溶液,滴加______ (填试剂),观察到______ (填现象)。
 、
、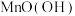 、
、 和少量
和少量 、
、 及炭黑等,为了保护环境、充分利用锰资源,通过如图流程制备
及炭黑等,为了保护环境、充分利用锰资源,通过如图流程制备 。
。
回答下列问题:
(1)“滤液a”的主要成分为
 ,另外还含有少量
,另外还含有少量 等。
等。①用离子方程式表示“滤液a“呈酸性的原因:
②根据如图所示的溶解度曲线,将“滤液a”
 固体。
固体。
(2)“熔炒”的目的是除炭、氧化
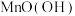 等。空气中
等。空气中 氧化
氧化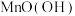 的化学方程式为
的化学方程式为(3)探究“酸浸”中
 溶解的适宜操作。
溶解的适宜操作。实验Ⅰ.向
 中加入
中加入 溶液,产生大量气泡;再加入稀
溶液,产生大量气泡;再加入稀 ,固体未明显溶解。
,固体未明显溶解。实验Ⅱ.向
 中加入稀
中加入稀 ,固体未溶解;再加入
,固体未溶解;再加入 溶液,产生大量气泡,固体完全溶解。
溶液,产生大量气泡,固体完全溶解。实验Ⅰ中
 的作用是
的作用是 的作用是
的作用是(4)证明
 溶液中
溶液中 沉淀完全:取少量溶液,滴加
沉淀完全:取少量溶液,滴加
您最近一年使用:0次
2 . 某小组同学探究铁离子与苯酚的反应。
已知:Fe3++6C6H5O [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、___________ 。
(2)氯化铁溶液呈___________ (填“酸性”或“碱性”),用离子方程式表示原因___________ 。
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是___________ 。
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
①向实验2反应后溶液中加入___________ ,溶液颜色无变化,证明猜想i不成立。
②实验证明猜想ii成立,请写出实验操作和现象___________ 。
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释___________ 。
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由___________ 。
(7)由以上研究可知,影响铁离子与苯酚反应的因素有___________ 。
已知:Fe3++6C6H5O
 [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
(2)氯化铁溶液呈
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。①向实验2反应后溶液中加入
②实验证明猜想ii成立,请写出实验操作和现象
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由
(7)由以上研究可知,影响铁离子与苯酚反应的因素有
您最近一年使用:0次
3 . 下列说法正确的是
A.碳酸钠溶液显碱性: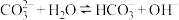 |
B.向盐酸中加入氨水至中性,溶液中 |
C.弱酸酸式盐NaHB在水溶液中水解: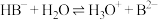 |
| D.向丙烯醛中加入溴水,溴水褪色,证明丙烯醛中含有碳碳双键 |
您最近一年使用:0次
解题方法
4 . 实验小组对Mg与NH4Cl溶液的反应进行探究。
(1)用pH计测定1.0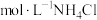 溶液约为4.6,分析NH4Cl溶液呈酸性的原因
溶液约为4.6,分析NH4Cl溶液呈酸性的原因______ (用化学用语表示)。
(2)探究镁与NH4Cl溶液的反应:实验Ⅰ、Ⅱ所取镁粉质量均为0.5g,分别加入选取的实验试剂中。
①实验Ⅰ中发生反应的化学方程式为______ 。
②经检验实验Ⅱ中刺激性气味气体为NH3和H2的混合气体,用平衡移动原理解释产生NH3的原因______ 。
③已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有______ ,灰白色固体可能是______ (填化学式)。
④针对实验Ⅱ比实验Ⅰ反应剧烈的原因,小组同学提出了两种假设:
假设l:NH4Cl溶液中的H+溶解了Mg(OH)2;
假设2:NH4Cl溶液中的 溶解了Mg(OH)2。
溶解了Mg(OH)2。
为证明假设的合理性.小组同学做了如下对比实验:
实验结论是______ 。
(3)甲同学通过深入思考,认为Mg与NH4Cl溶液反应剧烈.可能还与 有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为
有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为______ 。
(4)由上述实验得出的结论是______ 。
(1)用pH计测定1.0
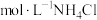 溶液约为4.6,分析NH4Cl溶液呈酸性的原因
溶液约为4.6,分析NH4Cl溶液呈酸性的原因(2)探究镁与NH4Cl溶液的反应:实验Ⅰ、Ⅱ所取镁粉质量均为0.5g,分别加入选取的实验试剂中。
实验 | 实验试剂 | 实验现象 |
Ⅰ | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
Ⅱ | 5mL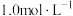 NH4Cl溶液(pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
②经检验实验Ⅱ中刺激性气味气体为NH3和H2的混合气体,用平衡移动原理解释产生NH3的原因
③已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有
④针对实验Ⅱ比实验Ⅰ反应剧烈的原因,小组同学提出了两种假设:
假设l:NH4Cl溶液中的H+溶解了Mg(OH)2;
假设2:NH4Cl溶液中的
 溶解了Mg(OH)2。
溶解了Mg(OH)2。为证明假设的合理性.小组同学做了如下对比实验:
实验 | 实验方案 | 实验现象 |
Ⅲ | 取2根覆盖了Mg(OH)2的Mg条,分别同时放入相同体积相同pH的盐酸和饱和NH4Cl溶液中。 | 饱和NH4Cl溶液中反应更剧烈。 |
Ⅳ | 向饱和NH4Cl溶液中滴加浓氨水,使溶液呈中性或略显碱性,再放入覆盖了Mg(OH)2的镁条。 | 剧烈反应,但是比实验Ⅲ饱和NH4Cl溶液略慢,产生刺激性气味气体和灰白色难溶固体。 |
(3)甲同学通过深入思考,认为Mg与NH4Cl溶液反应剧烈.可能还与
 有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为
有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为(4)由上述实验得出的结论是
您最近一年使用:0次
2024-01-24更新
|
85次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
解题方法
5 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。

回答下列问题:
(1)Mn的原子结构示意图为___________ 。
(2)“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。
①用离子方程式表示“滤液a”呈酸性的原因___________ 。
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、___________ 、洗涤、干燥,得NH4Cl固体。

(3)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为___________ 。
(4)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验II.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是___________ ,实验II中H2O2的作用是___________ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是___________ 。
(5)加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加___________ (填试剂),观察到___________ (填现象)。

回答下列问题:
(1)Mn的原子结构示意图为
(2)“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。
①用离子方程式表示“滤液a”呈酸性的原因
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、

(3)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(4)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验II.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(5)加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加
您最近一年使用:0次
解题方法
6 . I.某化学兴趣小组探究铁粉与硫酸铜溶液反应时溶液pH变化。
(1)甲同学提出硫酸铜溶液显酸性,理由是_______ (写离子方程式),加入铁粉消耗了 和
和 ,溶液pH会
,溶液pH会_______ (填“增大”、“不变”或“减小”;已知相同条件下, 的水解程度强于
的水解程度强于 )。
)。
Ⅱ.乙同学用pH传感器测铁粉和 溶液反应时溶液pH的变化。
溶液反应时溶液pH的变化。
【实验用品】仪器:pH传感器、笔记本电脑、带橡皮塞的 三颈烧瓶、铁架台、分液漏斗等。
三颈烧瓶、铁架台、分液漏斗等。
试剂: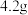 铁粉、
铁粉、 溶液。
溶液。
【实验步骤】向三颈烧瓶中加入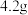 铁粉,将
铁粉,将 溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
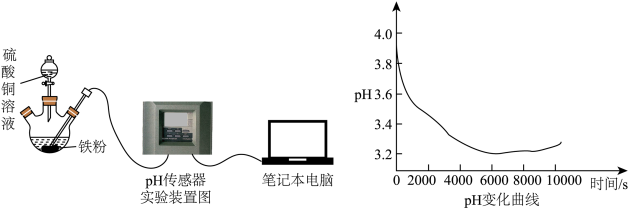
(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是_______ (写离子方程式;常温下, 在
在 时完全沉淀)。
时完全沉淀)。
(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制 溶液,重新进行实验。
溶液,重新进行实验。
①配制 溶液所用的蒸馏水需提前煮沸、冷却的目的是
溶液所用的蒸馏水需提前煮沸、冷却的目的是_______ ,配制 溶液需要称量
溶液需要称量_______ (保留小数点后一位)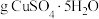 。
。
②下列实验操作会使所配制的溶液浓度偏高的是_______ (填标号)。
a.所称量的 失去部分结晶水
失去部分结晶水
b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d.未用 溶液润洗容量瓶
溶液润洗容量瓶
③改进之后测得溶液pH的变化趋势为_______ ,证明乙同学的猜想正确(忽略容器内空气对实验的影响)。
(1)甲同学提出硫酸铜溶液显酸性,理由是
 和
和 ,溶液pH会
,溶液pH会 的水解程度强于
的水解程度强于 )。
)。Ⅱ.乙同学用pH传感器测铁粉和
 溶液反应时溶液pH的变化。
溶液反应时溶液pH的变化。【实验用品】仪器:pH传感器、笔记本电脑、带橡皮塞的
 三颈烧瓶、铁架台、分液漏斗等。
三颈烧瓶、铁架台、分液漏斗等。试剂:
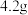 铁粉、
铁粉、 溶液。
溶液。【实验步骤】向三颈烧瓶中加入
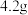 铁粉,将
铁粉,将 溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是
 在
在 时完全沉淀)。
时完全沉淀)。(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制
 溶液,重新进行实验。
溶液,重新进行实验。①配制
 溶液所用的蒸馏水需提前煮沸、冷却的目的是
溶液所用的蒸馏水需提前煮沸、冷却的目的是 溶液需要称量
溶液需要称量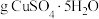 。
。②下列实验操作会使所配制的溶液浓度偏高的是
a.所称量的
 失去部分结晶水
失去部分结晶水b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d.未用
 溶液润洗容量瓶
溶液润洗容量瓶③改进之后测得溶液pH的变化趋势为
您最近一年使用:0次
解题方法
7 . 某研究小组探究不同条件对电解 溶液微粒放电能力的影响。配制0.1
溶液微粒放电能力的影响。配制0.1
 溶液,设计如下图所示的实验装置进行电解,实验记录如下:
溶液,设计如下图所示的实验装置进行电解,实验记录如下:

(1)0.1
 溶液
溶液 ,用离子方程式表示其显酸性的原因
,用离子方程式表示其显酸性的原因_________ 。
(2)预测电解 溶液时,阳极放电的微粒可能是
溶液时,阳极放电的微粒可能是_________ 。
(3)分析阴极实验现象
①实验Ⅰ中,阴极的电极反应是_________ 。
②对比实验Ⅰ、II阴极现象,可以得出的结论是_________ 。
(4)分析阳极实验现象
①甲同学得出结论:实验Ⅰ、Ⅱ条件下, 放电而
放电而 没有放电。“
没有放电。“ 放电”的实验证据是
放电”的实验证据是_________ 。
②乙同学认为仅由实验Ⅰ、Ⅱ不能得出此结论,并提出 可能放电,
可能放电, 的产生可能有两种途径。
的产生可能有两种途径。
途径1: 在阳极放电产生
在阳极放电产生 。
。
途径2:_________ 产生 。
。
(5)Ⅰ中虽未检测出 ,但
,但 在实验Ⅰ条件下是否放电仍需进一步证明。小组设计实验Ⅰ的对照实验完成验证,该实验方案是
在实验Ⅰ条件下是否放电仍需进一步证明。小组设计实验Ⅰ的对照实验完成验证,该实验方案是_________ 。
 溶液微粒放电能力的影响。配制0.1
溶液微粒放电能力的影响。配制0.1
 溶液,设计如下图所示的实验装置进行电解,实验记录如下:
溶液,设计如下图所示的实验装置进行电解,实验记录如下:
| 序号 | 电压 | pH | 阴极现象 | 阳极现象 |
| Ⅰ | 1.5V | 5.52 | 无气泡产生;电极表面有银灰色金属析出 | 无气泡产生,湿润淀粉碘化钾不变蓝;电极表面逐渐析出红褐色沉淀 |
| Ⅱ | 1.5V | -0.5 | 有气泡产生;电极表面有极少量银灰色金属析出 | 无气泡产生,湿润淀粉碘化钾不变蓝;取阳极附近溶液,滴加 溶液变红 溶液变红 |
(1)0.1

 溶液
溶液 ,用离子方程式表示其显酸性的原因
,用离子方程式表示其显酸性的原因(2)预测电解
 溶液时,阳极放电的微粒可能是
溶液时,阳极放电的微粒可能是(3)分析阴极实验现象
①实验Ⅰ中,阴极的电极反应是
②对比实验Ⅰ、II阴极现象,可以得出的结论是
(4)分析阳极实验现象
①甲同学得出结论:实验Ⅰ、Ⅱ条件下,
 放电而
放电而 没有放电。“
没有放电。“ 放电”的实验证据是
放电”的实验证据是②乙同学认为仅由实验Ⅰ、Ⅱ不能得出此结论,并提出
 可能放电,
可能放电, 的产生可能有两种途径。
的产生可能有两种途径。途径1:
 在阳极放电产生
在阳极放电产生 。
。途径2:
 。
。(5)Ⅰ中虽未检测出
 ,但
,但 在实验Ⅰ条件下是否放电仍需进一步证明。小组设计实验Ⅰ的对照实验完成验证,该实验方案是
在实验Ⅰ条件下是否放电仍需进一步证明。小组设计实验Ⅰ的对照实验完成验证,该实验方案是
您最近一年使用:0次
2023高三·全国·专题练习
8 . 下列反应的离子方程式不正确 的是_______ 。
A. (2019·天津高考)向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. (2019年6月·浙江学考真题)一水合氨在水中的电离方程式:NH3·H2O=NH +OH-
+OH-
C. (2018·浙江6月学考真题)碳酸钠水解的离子方程式:CO +2H2O=H2CO3+2OH-
+2H2O=H2CO3+2OH-
D. (2016·天津高考)室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH +2H2O=NH3·H2O+H3O+
+2H2O=NH3·H2O+H3O+
E.NaHS水溶液显碱性:HS-+H2O S2-+H3O+
S2-+H3O+
F.Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO +2OH-=MgCO3↓+CO
+2OH-=MgCO3↓+CO +2H2O
+2H2O
G.侯氏制碱法中NaHCO3的制备:Na++NH3+CO2+H2O=NaHCO3↓+NH
A. (2019·天津高考)向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O
 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+B. (2019年6月·浙江学考真题)一水合氨在水中的电离方程式:NH3·H2O=NH
 +OH-
+OH-C. (2018·浙江6月学考真题)碳酸钠水解的离子方程式:CO
 +2H2O=H2CO3+2OH-
+2H2O=H2CO3+2OH-D. (2016·天津高考)室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH
 +2H2O=NH3·H2O+H3O+
+2H2O=NH3·H2O+H3O+E.NaHS水溶液显碱性:HS-+H2O
 S2-+H3O+
S2-+H3O+F.Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO
 +2OH-=MgCO3↓+CO
+2OH-=MgCO3↓+CO +2H2O
+2H2OG.侯氏制碱法中NaHCO3的制备:Na++NH3+CO2+H2O=NaHCO3↓+NH

您最近一年使用:0次
9 .  室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH
室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH +2H2O=NH3·H2O+H3O+ 。(_______)
+2H2O=NH3·H2O+H3O+ 。(_______)
 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH
室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH +2H2O=NH3·H2O+H3O+ 。(_______)
+2H2O=NH3·H2O+H3O+ 。(_______)
您最近一年使用:0次
10 . 科学家们通过精确的导电性实验证明,纯水中除了大量的水分子,还存在极少量的H3O+和OH-,根据这个信息推断,下列叙述错误的是
| A.水中存在极少量的H3O+和OH-,说明水是一种极弱的电解质 |
| B.常温下,水的电离需要通电才能进行 |
C.若液氨的电离与水相似,则液氨的电离方程式可以表示为2NH3 NH NH +NH +NH |
| D.蒸馏水也能导电,只是导电能力非常弱 |
您最近一年使用:0次
2022-10-14更新
|
270次组卷
|
3卷引用:湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题6-10)
(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题6-10)辽宁省沈阳市第二十中学2022-2023学年高一上学期第一次月考化学试题湖北省宜昌市夷陵中学2022-2023学年高一上学期期中考试化学试题



