名校
1 . 短周期主族元素A、B、C、D的原子序数依次增大。已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是
| A.简单离子的半径:B>C>D | B.B与D形成的化合物溶于水所得溶液显酸性 |
| C.C与D不可能形成化合物C2D2 | D.B与C形成的化合物在水溶液中能稳定存在 |
您最近一年使用:0次
2 . 对H2O的电离平衡不产生影响的粒子是( )
A.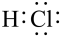 | B.26Fe3+ | C.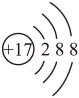 | D. |
您最近一年使用:0次
2018-01-06更新
|
555次组卷
|
40卷引用:2011-2012学年辽宁省东北育才学校高二上学期期中考试化学试卷
(已下线)2011-2012学年辽宁省东北育才学校高二上学期期中考试化学试卷辽宁省辽阳2017-2018学年高二化学上学期期末考试题辽宁省重点高中沈阳市郊联体2022-2023学年高二上学期期中考试化学试题(已下线)2011届温州市高三八校联考化学试卷(已下线)2010-2011学年河北省正定中学高二上学期期末考试化学试卷(已下线)2011-2012年黑龙江省鹤岗一中高二上学期期中考试化学试卷(已下线)2011-2012学年河南省卫辉市第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年山西省山大附中高二12月月考化学试卷(已下线)2011-2012学年山东省莘县实验高中高二12月月考化学试卷(已下线)2012届福建省龙岩市高三教学质量检测化学试卷(已下线)2012届海南省琼海市高考模拟测试(一)化学试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2012-2013学年吉林省吉林一中高二上学期期中考试化学试卷(已下线)2013-2014学年浙江省杭州地区七校高二上学期期中考试化学试卷(已下线)2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(已下线)2013-2014学年内蒙古包头三十三中高二下学期期中考试理科化学试卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷(已下线)2014届内蒙古包钢一中高二下学期期中Ⅰ考试化学试卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷2015届广西玉林市博白县高三下学期返校调研考试化学试卷湖北省宜昌市部分示范高中教学协作体2016-2017学年高二下学期期中考试化学试题湖北省宜昌市示范高中协作体2016-2017学年高二下学期期中考试化学试题福建省莆田市第七中学2016-2017学年高二下学期第二次月考化学试题云南省楚雄州2016-2017学年高二下学期期末考试化学试题山东省枣庄市第八中学南校区2017-2018学年高二上学期第二次月考(12月)化学试题河南省安阳县第一高级中学2017-2018学年高二上学期第三次月考化学试卷江西省奉新县第一中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年10月4日 《每日一题》一轮复习-水的电离及其影响因素甘肃省岷县二中2018-2019学年高二上学期第三次月考化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题(已下线)2019年10月3日 《每日一题》2020年高考一轮复习 —— 水的电离及其影响因素人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 教材帮(已下线)【全国百强校】内蒙古赤峰二中2018-2019学年高二下学期第二次月考化学试题河南省宏力学校2020-2021学年高二上学期期末考试化学试题湖南省长沙市南雅中学2018-2019学年高二上学期期中考试化学试题陕西省汉中中学2021-2022学年高二上学期第三次月考化学试题黑龙江省绥化市庆安县第一中学2022-2023学年高二上学期期中考试化学试题黑龙江省绥化市庆安县第一中学2022-2023学年高二上学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题湖北省孝感市2023-2024学年高二上学期11月期中考试化学试题
解题方法
3 .
(1)AgNO3的水溶液呈___ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________ ;
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式________________________ .
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为________________ (已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________ 。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图象,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。

①相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是_______ ,图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是______________ 。
②由图可得Fe(OH)2的溶度积的值为__________________________ 。
(1)AgNO3的水溶液呈
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为
 N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图象,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。

①相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是
②由图可得Fe(OH)2的溶度积的值为
您最近一年使用:0次
名校
4 . 常温下,在下列溶液中可能大量共存的离子组是( )
| A.pH=0的溶液:Fe2+、Mg2+、NO3﹣、SO42﹣ |
| B.由水电离出的c(H+)=1×10﹣13mol/L的溶液:Al3+、K+、SO42﹣、Cl﹣ |
| C.c(OH-)/c(H+)=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣ |
| D.pH=14的溶液:Na+、K+、Al3+、S2﹣ |
您最近一年使用:0次
2018-01-02更新
|
307次组卷
|
3卷引用:辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题
辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题(已下线)黄金30题系列++高二化学(选修4)++++小题好拿分【基础版】福建南平市第一高级中学2018-2019学年高二上学期第一次月考化学试题
名校
5 . 化学方程式是能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握的一项基本技能。请按照要求完成下列方程式。
(1)写出 泡沫灭火器反应原理的离子方程式:______ .
(2)工业制粗硅的化学反应方程式:_____________
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应离子反应方程式:______ 。
(4)亚硝酸盐是食品添加剂中毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色交为绿色,且亚硝酸根被氧化成硝酸根,试写出反应的离子方程式:___________
(5)将NaClO溶液逐滴滴入含淀粉的NaI溶液中,溶液变蓝,继续滴加,溶液颜色先加深,后逐渐变浅,最终消失。经检测得知此时溶液中含有一种含正五价元素的含氧酸根。写出上述变化过程中第二个反应的离子反应方程式:___________
(1)写出 泡沫灭火器反应原理的离子方程式:
(2)工业制粗硅的化学反应方程式:
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应离子反应方程式:
(4)亚硝酸盐是食品添加剂中毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色交为绿色,且亚硝酸根被氧化成硝酸根,试写出反应的离子方程式:
(5)将NaClO溶液逐滴滴入含淀粉的NaI溶液中,溶液变蓝,继续滴加,溶液颜色先加深,后逐渐变浅,最终消失。经检测得知此时溶液中含有一种含正五价元素的含氧酸根。写出上述变化过程中第二个反应的离子反应方程式:
您最近一年使用:0次
名校
6 . “化学实验→观察现象→分析推理→得出结论”是化学学习的方法之一。下列说法正确的是
| A.证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉-KI 试纸检验,观察试纸颜色变化 |
| B.将SO2通入足量稀Fe(NO3)3溶液,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2∶3 |
| C.验证淀粉的水解产物是否具有还原性,取水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀 |
| D.向铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色褪去,该过程中发生的反应为 2Al+3Ag2S=6Ag+Al2S3 |
您最近一年使用:0次
2017-05-18更新
|
1443次组卷
|
6卷引用:辽宁省沈阳铁路实验中学2020届高三11月月考化学试题
解题方法
7 . 某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种组成,取该溶液进行如下实验:
中的若干种组成,取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题。
(1)溶液中一定不存在的离子是___________ ;
(2)一定存在的离子是___________ ;写出产生沉淀甲的离子方程式:___________ ;
(3)判断沉淀乙成分的方法是___________
 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种组成,取该溶液进行如下实验:
中的若干种组成,取该溶液进行如下实验:(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题。
(1)溶液中一定不存在的离子是
(2)一定存在的离子是
(3)判断沉淀乙成分的方法是
您最近一年使用:0次
8 . 下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、I—、Br—可以大量共存 |
| B.用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 |
| C.将该溶液蒸干,得到的固体中混有氢氧化铁 |
| D.100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
您最近一年使用:0次
2016-12-09更新
|
372次组卷
|
5卷引用:2016届辽宁省葫芦岛市高三上学期期末调研化学试卷
9 . 化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| A.用含有铁粉的透气小袋与食品一起密封包装,说明铁粉能吸收水分 |
| B.浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 |
| C.硫酸铝与碳酸氢钠能制作泡沫灭火剂,利用了硫酸铝溶液与碳酸氢钠溶液混合后能发生剧烈双水解反应 |
| D.用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
您最近一年使用:0次
2016-12-09更新
|
414次组卷
|
3卷引用:辽宁省沈阳市东北育才学校2018届高三第三次模拟考试化学试题
名校
10 . 下列选项中,离子方程式书写正确的是
A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++ = 3Fe3++ 2H2O+NO↑ = 3Fe3++ 2H2O+NO↑ |
B.泡沫灭火器的灭火原理:2Al3+ +3 +3H2O = 2Al(OH)3↓+ 3CO2↑ +3H2O = 2Al(OH)3↓+ 3CO2↑ |
C.向硝酸银溶液中加入足量的氨水:Ag+ +2NH3·H2O Ag(NH3) Ag(NH3) + 2H2O + 2H2O |
D.用足量的氨水处理硫酸工业的尾气:SO2+ NH3·H2O = + +  |
您最近一年使用:0次
2016-12-09更新
|
340次组卷
|
7卷引用:2016届辽宁省沈阳市第二中学高三下第一次模拟理综化学试卷
2016届辽宁省沈阳市第二中学高三下第一次模拟理综化学试卷2015届湖南省长沙市长郡中学高三第二次联考理综化学试卷(已下线)二轮复习 专题4 离子反应 押题专练(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(押题专练)湖北省荆州市公安县第三中学2022-2023学年高三上学期8月月考化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题湖南攸县长鸿实验中学2022-2023学年高三上学期第二次月考化学试题



