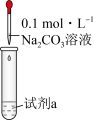
1 . 下列离子方程式或电极反应式书写不正确的是
A.CaS与浓硝酸反应: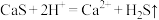 |
B.用硫化亚铁除去废水中的汞离子: |
C.泡沫灭火器的反应原理是: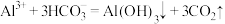 |
D. 溶液与过量 溶液与过量 反应: 反应: |
您最近一年使用:0次
名校
解题方法
2 . 常温下,下列各组离子在指定溶液中一定能大量共存的有几组
①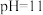 的溶液中:
的溶液中: 、
、 、
、 、
、
②2mol/的HCl溶液中: 、
、 、
、 、
、
③加入Al能放出 的溶液中:
的溶液中: 、
、 、
、 、
、
④由水电离出的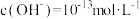 的溶液中:
的溶液中: 、
、 、
、 、
、
⑤1mol/L的 溶液中:
溶液中: 、
、 、
、 、
、
①
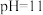 的溶液中:
的溶液中: 、
、 、
、 、
、
②2mol/的HCl溶液中:
 、
、 、
、 、
、
③加入Al能放出
 的溶液中:
的溶液中: 、
、 、
、 、
、
④由水电离出的
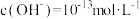 的溶液中:
的溶液中: 、
、 、
、 、
、
⑤1mol/L的
 溶液中:
溶液中: 、
、 、
、 、
、
| A.1组 | B.2组 | C.3组 | D.4组 |
您最近一年使用:0次
3 . 下列有关铁及其化合物的实验方案,对应的现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 将红热的铁与水蒸气在高温条件下反应,反应结束后,将磁铁靠近产物 | 反应结束后有黑色固体生成,且该固体被磁铁吸引 | 铁与水蒸气在高温下反应,生成Fe3O4 |
| B | 取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量。再加入过量稀盐酸和BaCl2溶液 | 加入稀盐酸前,溶液由黄色变为红棕色。加入稀盐酸和BaCl2溶液后产生白色沉淀 | Fe3+和 既发生氧化还原反应,也发生双水解 既发生氧化还原反应,也发生双水解 |
| C | 为了验证Fe2+的还原性,取FeCl2溶液于试管中,加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫色褪去 | Fe2+具有还原性 |
| D | 向少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后再滴加2滴硫氰化钾溶液 | 溶液变血红色 | CN-与Fe3+的配位能力小于SCN- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024·黑龙江·模拟预测
4 . 下列化学事实对应的原理或解释正确的是
| 化学事实 | 原理或解释 | |
| A |  溶液腐蚀覆铜板制作印刷电路板 溶液腐蚀覆铜板制作印刷电路板 | 铁的金属性比铜强 |
| B | 向NaAlO2溶液中滴加NaHCO3溶液,有白色沉淀生成 | 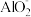 与 与 均发生水解反应并相互促进 均发生水解反应并相互促进 |
| C | 牧民喜欢用银器盛放鲜牛奶 | 溶入极微量的银离子,可杀死牛奶中的细菌,防止变质 |
| D | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 在下列溶液中能大量共存的是
A.在0.1 mol·L-1 NaHCO3溶液中:Al3+、Mg2+、 、Cl- 、Cl- |
B.在0.1 mol·L-1 H2S溶液中:Fe3+、 、Cl-、 、Cl-、 |
C.在0.1 mol·L-1 Ba(OH)2溶液中:Na+、K+、 、Br- 、Br- |
D.在0.1 mol·L-1 NH3·H2O溶液中:Cu2+、 、 、 、 、 |
您最近一年使用:0次
6 . 碳酸钠俗称纯碱,是一种重要的化工原料,在生活、生产和实验研究中均有广泛应用。某学习小组探究 溶液与盐溶液反应的产物,进行如下实验。
溶液与盐溶液反应的产物,进行如下实验。
(1)配制100mL 的
的 溶液。
溶液。
①配制溶液过程中用托盘天平称量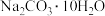 固体的质量为
固体的质量为_______ g。
②定容时,加蒸馏水不慎超过刻度线,处理的方法是_______ 。
(2)通过下列实验探究 溶液与盐溶液反应,记录实验现象如下表:
溶液与盐溶液反应,记录实验现象如下表:
为了探究白色沉淀的成分,设计了热分解实验,其装置如图所示:
①实验甲产生白色沉淀反应的离子方程式为_______ 。
②装置E的作用是_______ 。
③通过热分解实验可判断实验乙所得白色沉淀的成分为_______ (填化学式),实验乙反应的离子方程式为_______ 。
④实验丙所得白色沉淀的化学式可表示为 ,则
,则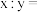
_______ 。
 溶液与盐溶液反应的产物,进行如下实验。
溶液与盐溶液反应的产物,进行如下实验。(1)配制100mL
 的
的 溶液。
溶液。①配制溶液过程中用托盘天平称量
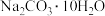 固体的质量为
固体的质量为②定容时,加蒸馏水不慎超过刻度线,处理的方法是
(2)通过下列实验探究
 溶液与盐溶液反应,记录实验现象如下表:
溶液与盐溶液反应,记录实验现象如下表:| 装置 | 实验 | 试剂a | 现象 |
| 甲 | 4mL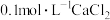 溶液 溶液 | 产生白色沉淀 |
| 乙 | 4mL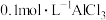 溶液 溶液 | 产生白色沉淀及大量气体 | |
| 丙 | 4mL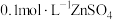 溶液 溶液 | 产生白色沉淀及大量气体 |

| 样品 | 加热前样品质量/g | 加热后样品质量/g | 装置C增重/g | 装置D增重/g |
| 实验乙样品 | 10.4 | 6.8 | 3.6 | 0 |
| 实验丙样品 | 22.4 | 16.2 | 1.8 | 4.4 |
②装置E的作用是
③通过热分解实验可判断实验乙所得白色沉淀的成分为
④实验丙所得白色沉淀的化学式可表示为
 ,则
,则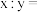
您最近一年使用:0次
7 . A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。五种元素两两形成的化合物有甲、乙、两、丁四种分子中原子个数比如下表:
(1)写出元素符号:B___________ ,E___________ 。
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为___________ 。物质丁的分子为___________ 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是___________ 。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为___________ 。
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个比 | A∶C=1∶1 | B∶A=1∶2 | D∶E=1∶3 | B∶E=1∶4 |
(1)写出元素符号:B
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为
(3)向甲的水溶液中加入MnO2,氧化产物是
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为
您最近一年使用:0次
解题方法
8 . a、b、c、d四种短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示.下列说法正确的是
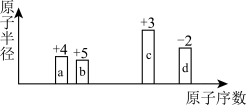
| A.离子半径的大小顺序:b<c<d | B.简单氢化物的沸点:d>b>a |
| C.b、d的氢化物可化合生成离子化合物 | D.分别含c3+与d2-的盐溶液相混会生成c2d3沉淀 |
您最近一年使用:0次
9 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在新制饱和氯水中: 、 、 、 、 、 、 |
B.在能使酚酞变红的溶液中: 、 、 、 、 、 、 |
C.在加入铝粉能产生 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D.在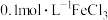 的溶液中: 的溶液中: 、 、 、 、 、 、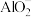 |
您最近一年使用:0次
解题方法
10 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用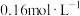
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有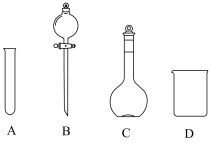
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用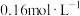
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
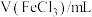 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
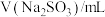 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近一年使用:0次