解题方法
1 . 甲胺( )是一种一元弱碱。常温下,向
)是一种一元弱碱。常温下,向 中加入等体积
中加入等体积 的
的 。下列说法中正确的是
。下列说法中正确的是
 )是一种一元弱碱。常温下,向
)是一种一元弱碱。常温下,向 中加入等体积
中加入等体积 的
的 。下列说法中正确的是
。下列说法中正确的是A. 在水溶液的电离方程式为: 在水溶液的电离方程式为: |
B.混合后溶液中 |
C. 的 的 溶液中,水电离出来的 溶液中,水电离出来的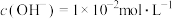 |
D.混合后的溶液中: |
您最近一年使用:0次
2 . 常温下,物质的量浓度相等,体积均为 的MOH和ROH溶液,分别加水稀释至体积V,pH随
的MOH和ROH溶液,分别加水稀释至体积V,pH随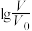 的变化如图,下列叙述错误的是
的变化如图,下列叙述错误的是

 的MOH和ROH溶液,分别加水稀释至体积V,pH随
的MOH和ROH溶液,分别加水稀释至体积V,pH随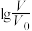 的变化如图,下列叙述错误的是
的变化如图,下列叙述错误的是
| A.稀释前,ROH溶液物质的量浓度约为0.1mol/L |
B. 时,MOH溶液的 时,MOH溶液的 |
C.a点和b点溶液均满足: |
D.等体积等物质的量浓度的盐酸、MOH、ROH溶液混合后: |
您最近一年使用:0次
名校
3 . 盐碱地是土壤表层集聚过多盐碱成分,对农作物有害的土地。回答下列问题:
(1)盐碱地(含较多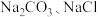 )不利于植物生长,盐碱地呈碱性的原因为
)不利于植物生长,盐碱地呈碱性的原因为___________ (用离子方程式说明);已知 时,
时, 的
的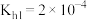 ,则当
,则当 溶液中
溶液中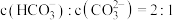 时,溶液的
时,溶液的
___________ 。
(2) 是农作物生长过程中不可缺少的微量元素。常用的铜肥是胆矾,在盐碱地施用胆矾时宜将其溶液
是农作物生长过程中不可缺少的微量元素。常用的铜肥是胆矾,在盐碱地施用胆矾时宜将其溶液___________ (填“喷在叶片上”或“随水灌入土壤中”),主要理由是___________ 。
(3)已知:常温下,碳酸的电离平衡常数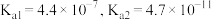 。常温下,向
。常温下,向 溶液中缓慢滴加
溶液中缓慢滴加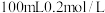 盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示(
盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示( 和
和 未画出)。根据图回答下列问题:
未画出)。根据图回答下列问题:
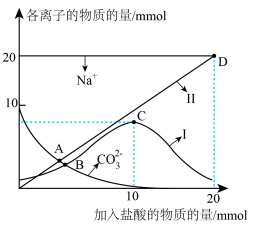
①曲线Ⅰ代表的离子是_______ 。
②A、B两点水的电离程度大小为A_______ B。
③根据上图,下列有关说法不正确的是_______ 。
a.滴加至 点时,
点时,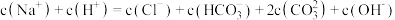
b.滴加至 点时,
点时,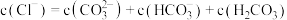
c.滴加至 点时,溶液
点时,溶液
④已知 电离平衡常数约为
电离平衡常数约为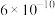 ,用一个离子方程式说明
,用一个离子方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱_______ 。
⑤证明 是弱电解质,你的设计方案是
是弱电解质,你的设计方案是_______ 。
(1)盐碱地(含较多
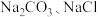 )不利于植物生长,盐碱地呈碱性的原因为
)不利于植物生长,盐碱地呈碱性的原因为 时,
时, 的
的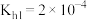 ,则当
,则当 溶液中
溶液中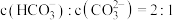 时,溶液的
时,溶液的
(2)
 是农作物生长过程中不可缺少的微量元素。常用的铜肥是胆矾,在盐碱地施用胆矾时宜将其溶液
是农作物生长过程中不可缺少的微量元素。常用的铜肥是胆矾,在盐碱地施用胆矾时宜将其溶液(3)已知:常温下,碳酸的电离平衡常数
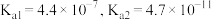 。常温下,向
。常温下,向 溶液中缓慢滴加
溶液中缓慢滴加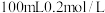 盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示(
盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示( 和
和 未画出)。根据图回答下列问题:
未画出)。根据图回答下列问题:
①曲线Ⅰ代表的离子是
②A、B两点水的电离程度大小为A
③根据上图,下列有关说法不正确的是
a.滴加至
 点时,
点时,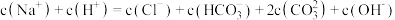
b.滴加至
 点时,
点时,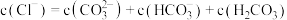
c.滴加至
 点时,溶液
点时,溶液
④已知
 电离平衡常数约为
电离平衡常数约为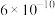 ,用一个离子方程式说明
,用一个离子方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱⑤证明
 是弱电解质,你的设计方案是
是弱电解质,你的设计方案是
您最近一年使用:0次
2023-12-13更新
|
64次组卷
|
2卷引用:广东省佛山市H7教育共同体2023-2024学年高二上学期联考化学试题
4 . 常温下,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
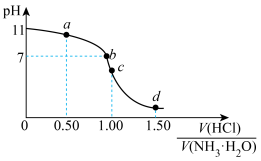
 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
A. 时, 时,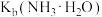 的数量级为 的数量级为 |
B. 点溶液中: 点溶液中: |
C.水的电离程度: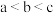 |
D. 点溶液中: 点溶液中: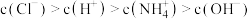 |
您最近一年使用:0次
2023-12-13更新
|
128次组卷
|
2卷引用:广东省佛山市H7教育共同体2023-2024学年高二上学期联考化学试题
名校
5 . 常温下,下列溶液中有关物质的量浓度的关系错误的是
A.pH相等的 、NaOH和 、NaOH和 三种溶液: 三种溶液: |
B.物质的量浓度相等的 和 和 溶液等体积混合: 溶液等体积混合: |
C. 的HA溶液与 的HA溶液与 的MOH溶液以任意比例混合: 的MOH溶液以任意比例混合: |
D. 的NaHA溶液的 的NaHA溶液的 : : |
您最近一年使用:0次
2023-06-08更新
|
151次组卷
|
2卷引用:广东省佛山市龙江中学、勒流中学、北滘中学等十五校2022-2023学年高二上学期12月联考化学试题
解题方法
6 .  溶液的
溶液的 随温度的变化如图所示。下列说法正确的是
随温度的变化如图所示。下列说法正确的是
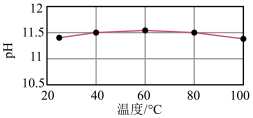
 溶液的
溶液的 随温度的变化如图所示。下列说法正确的是
随温度的变化如图所示。下列说法正确的是
| A.温度高于60℃时,pH变化主要受水的电离平衡移动的影响 |
B.常温下: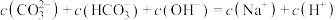 |
C.常温下: |
D.升高温度,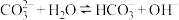 平衡逆向移动 平衡逆向移动 |
您最近一年使用:0次
名校
7 . 磷能形成次磷酸 、亚磷酸
、亚磷酸 等多种含氧酸,请根据所学知识回答下列问题:
等多种含氧酸,请根据所学知识回答下列问题:
(1)已知 溶液中存在的含磷微粒只有
溶液中存在的含磷微粒只有 、
、 。
。
① 属于
属于_________ 酸。
②写出将 的NaOH溶液逐滴加入10mL
的NaOH溶液逐滴加入10mL 溶液中至过量时发生反应的离子方程式:
溶液中至过量时发生反应的离子方程式:_________ 。
(2)亚磷酸 是二元中强酸,常温下,其电离平衡常数为
是二元中强酸,常温下,其电离平衡常数为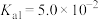 、
、 ,
, 。
。
①常温下, 的
的 溶液呈
溶液呈_________ (填“酸”或“碱”)性,该溶液中含磷微粒的浓度由大到小的顺序为_________ 。
②常温下,向 的
的 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,此时溶液中的
,此时溶液中的
_________ (填精确值) 。
。
③常温下,将NaOH溶液滴加到亚磷酸溶液中,混合溶液的pH随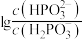 或
或 变化的关系如图所示。
变化的关系如图所示。
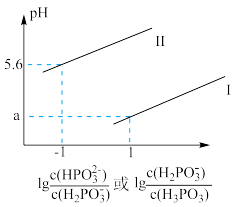
表示 的是曲线
的是曲线_________ (填“Ⅰ”或“Ⅱ”),
_________ 。
 、亚磷酸
、亚磷酸 等多种含氧酸,请根据所学知识回答下列问题:
等多种含氧酸,请根据所学知识回答下列问题:(1)已知
 溶液中存在的含磷微粒只有
溶液中存在的含磷微粒只有 、
、 。
。①
 属于
属于②写出将
 的NaOH溶液逐滴加入10mL
的NaOH溶液逐滴加入10mL 溶液中至过量时发生反应的离子方程式:
溶液中至过量时发生反应的离子方程式:(2)亚磷酸
 是二元中强酸,常温下,其电离平衡常数为
是二元中强酸,常温下,其电离平衡常数为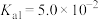 、
、 ,
, 。
。①常温下,
 的
的 溶液呈
溶液呈②常温下,向
 的
的 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,此时溶液中的
,此时溶液中的
 。
。③常温下,将NaOH溶液滴加到亚磷酸溶液中,混合溶液的pH随
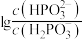 或
或 变化的关系如图所示。
变化的关系如图所示。
表示
 的是曲线
的是曲线
您最近一年使用:0次
2022-12-16更新
|
307次组卷
|
4卷引用:广东省佛山市龙江中学、勒流中学、北滘中学等十五校2022-2023学年高二上学期12月联考化学试题
名校
8 . 在0.1mol/LNa2CO3溶液中,各种微粒之间存在下列关系,其中正确的是
A.c(Na+)+c(H+)=2c(CO )+c(HCO )+c(HCO )+c(OH-) )+c(OH-) | B.2c(Na+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
C.c(OH-)=c(H+)+c(HCO )+c(H2CO3) )+c(H2CO3) | D.c(Na+)>c(OH-)>c(CO )>c(H+) )>c(H+) |
您最近一年使用:0次
2022-12-11更新
|
455次组卷
|
3卷引用:广东顺佛山市顺德区文德学校2021-2022学年高二上学期第二次阶段性测试化学试题
解题方法
9 . 亚硝酸是一种弱酸,Ka(HNO2)=5.6×10-4,NaNO2可用于滴定分析。
(1)常温下,0.1 mol/L的NaNO2溶液呈__________ (填“酸性”、“中性”或“碱性”);原因是__________ (用离子方程式表示)。
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是_______ (填写微粒化学式)。c(NO2-)+c(HNO2)=__________ mol/L。

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是_______ 。
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显_______ 色。
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
则该样品中对氨基苯磺酸的纯度是__________ 。
第二次实验数据出现异常,造成这种异常的原因可能是________ (填代号)。
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为_______ 。
(1)常温下,0.1 mol/L的NaNO2溶液呈
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗NaNO2溶液体积/mL | 20.12 | 20.90 | 20.00 | 19.88 |
第二次实验数据出现异常,造成这种异常的原因可能是
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为
您最近一年使用:0次
名校
解题方法
10 . G是一种有机碱,溶于水成碱性的原理:G+H2O GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
 GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是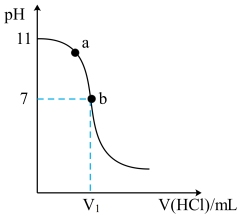
| A.G的近似电离常数是1×10-21 |
| B.V1>10 mL |
| C.水的电离程度:a<b |
| D.V(HCl)=20 mL 时,c(GH+)+c(G)=c(Cl-) |
您最近一年使用:0次
2022-11-27更新
|
204次组卷
|
2卷引用:广东省佛山市南海区2022-2023学年高二上学期学业水平测试化学试题



