解题方法
1 . 室温下,有浓度均为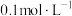 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
① ②
② ③
③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸 ;碳酸
;碳酸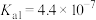 ,
, 。
。
(1)上述溶液加入水中,对水的电离无影响的是______ (填序号),溶液④中溶质与水作用的离子方程式为______ 。
(2)上述溶液的 由小到大的顺序为
由小到大的顺序为______ (填序号)。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③______ ④(填“大于”、“等于”或“小于”)。
(4)室温下,向溶液①中加水稀释至原体积的100倍,所得溶液的 为
为______ 。
(5)向20mL0.1mol/L 中滴加0.1mol/L
中滴加0.1mol/L 过程中,
过程中, 变化如图所示。
变化如图所示。
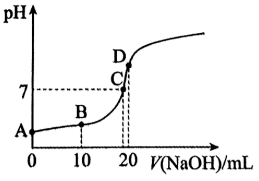
①滴加过程中发生反应的离子方程式是______ 。
②下列说法正确的是______ 。
a. 、
、 两点水的电离程度:
两点水的电离程度:
b. 点溶液中微粒浓度满足:
点溶液中微粒浓度满足: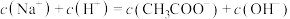
c. 点溶液微粒浓度满足:
点溶液微粒浓度满足: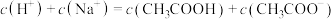
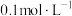 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①
 ②
② ③
③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
 ;碳酸
;碳酸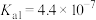 ,
, 。
。(1)上述溶液加入水中,对水的电离无影响的是
(2)上述溶液的
 由小到大的顺序为
由小到大的顺序为(3)比较溶液③和④中
 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的100倍,所得溶液的
 为
为(5)向20mL0.1mol/L
 中滴加0.1mol/L
中滴加0.1mol/L 过程中,
过程中, 变化如图所示。
变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a.
 、
、 两点水的电离程度:
两点水的电离程度:
b.
 点溶液中微粒浓度满足:
点溶液中微粒浓度满足: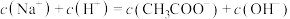
c.
 点溶液微粒浓度满足:
点溶液微粒浓度满足: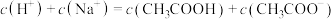
您最近一年使用:0次
2 . 在一定温度下,有以下三种酸:a.盐酸 b.硫酸 c.醋酸(用a、b、c填空)
(1)当三种酸物质的量浓度相同时, 由大到小的顺序是
由大到小的顺序是_______ 。
(2)若三者 相同时,物质的量浓度由大到小的顺序是
相同时,物质的量浓度由大到小的顺序是_______ 。
(3)同体积、同物质的量浓度的三种酸,中和 的能力由大到小的顺序是
的能力由大到小的顺序是_______ 。
(4)将 相同的三种酸均加水稀释至原来的100倍后,
相同的三种酸均加水稀释至原来的100倍后, 由大到小的顺序是
由大到小的顺序是_______ 。
(5)0.2 与0.1
与0.1 醋酸中
醋酸中 之比
之比_____  (填>、<、=)
(填>、<、=)
(6)0.1 醋酸溶液
醋酸溶液
_______  (填数值)。
(填数值)。
(1)当三种酸物质的量浓度相同时,
 由大到小的顺序是
由大到小的顺序是(2)若三者
 相同时,物质的量浓度由大到小的顺序是
相同时,物质的量浓度由大到小的顺序是(3)同体积、同物质的量浓度的三种酸,中和
 的能力由大到小的顺序是
的能力由大到小的顺序是(4)将
 相同的三种酸均加水稀释至原来的100倍后,
相同的三种酸均加水稀释至原来的100倍后, 由大到小的顺序是
由大到小的顺序是(5)0.2
 与0.1
与0.1 醋酸中
醋酸中 之比
之比 (填>、<、=)
(填>、<、=)(6)0.1
 醋酸溶液
醋酸溶液
 (填数值)。
(填数值)。
您最近一年使用:0次
名校
解题方法
3 . 某同学查阅资料发现,人体血液里由于存在重要的酸碱平衡:CO2+ H2O H2CO3
H2CO3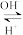 HCO
HCO ,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
(1)人体血液发生酸中毒时,可注射 ___________缓解(填字母)。
(2)已知25°C时,CO 水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO
水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=___________ 。
(3)亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如下图所示。

①NaH2AsO3溶液呈___________ (填 “酸”、“碱”或“中”)性:写出NaH2AsO3水解的离子方程式___________ 。
②将KOH溶液滴入H3AsO3溶液中,当pH从13调节至14时,所发生反应的离子方程式为___________ 。
③下列说法正确的是___________ (填字母)。
a. H3AsO3的电离平衡常数Ka1∙Ka2= 10a+b
b. H3AsO3溶液中: c(H2AsO ) + 2c(HAsO
) + 2c(HAsO ) + 3c(AsO
) + 3c(AsO ) + c(OH-) = c(H+)
) + c(OH-) = c(H+)
c. K3AsO3溶液中: c(K+)=3c (AsO ) +3c (HAsO
) +3c (HAsO )+3c (H2AsO
)+3c (H2AsO )
)
(4)医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。则要除去AsO ,溶液中的c(Ca2+)至少为
,溶液中的c(Ca2+)至少为___________ mol∙L−1。
{已知: Ksp[Ca3(AsO4)2]=8 × 10−19 mol5∙L−5,当残留在溶液中的离子浓度≤1 ×10−5 mol∙L−1,可认为沉淀完全}。
 H2CO3
H2CO3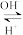 HCO
HCO ,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。(1)人体血液发生酸中毒时,可注射 ___________缓解(填字母)。
| A.NaOH溶液 | B.NaHCO3溶液 | C.NaCl溶液 | D.Na2SO4溶液 |
 水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO
水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(3)亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如下图所示。

①NaH2AsO3溶液呈
②将KOH溶液滴入H3AsO3溶液中,当pH从13调节至14时,所发生反应的离子方程式为
③下列说法正确的是
a. H3AsO3的电离平衡常数Ka1∙Ka2= 10a+b
b. H3AsO3溶液中: c(H2AsO
 ) + 2c(HAsO
) + 2c(HAsO ) + 3c(AsO
) + 3c(AsO ) + c(OH-) = c(H+)
) + c(OH-) = c(H+)c. K3AsO3溶液中: c(K+)=3c (AsO
 ) +3c (HAsO
) +3c (HAsO )+3c (H2AsO
)+3c (H2AsO )
)(4)医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。则要除去AsO
 ,溶液中的c(Ca2+)至少为
,溶液中的c(Ca2+)至少为{已知: Ksp[Ca3(AsO4)2]=8 × 10−19 mol5∙L−5,当残留在溶液中的离子浓度≤1 ×10−5 mol∙L−1,可认为沉淀完全}。
您最近一年使用:0次
2022-01-22更新
|
341次组卷
|
2卷引用:山东省菏泽市2021-2022学年高二上学期期末教学质量检测化学试题
解题方法
4 . 现有①0.2 mol·L-1 NaOH溶液 ②0.2 mol·L-1 HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则
(1)①中由水电离出的c(OH-)________ ②中由水电离出的c(H+) (填“>”、“=”或“<”)。
(2)上述混合液中共存在______ 种粒子,且c(HX)________ c(X-)(填“>”“=”或“<”,下同),c(HX)+c(X-)________ 0.1 mol·L-1(忽略体积变化)。
(3)上述混合液显________ 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为______________________________________ 。
(1)①中由水电离出的c(OH-)
(2)上述混合液中共存在
(3)上述混合液显
您最近一年使用:0次
2020-12-15更新
|
98次组卷
|
2卷引用:山东省烟台市中英文学校2020-2021学年高二10月月考化学试题
名校
5 . (1)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中HCO3―、CO32―、H2CO3 三种微粒的浓度由大到小 的顺序为:_______________________________ 。
(2)NaHCO3溶液与硫酸铝溶液混合的离子方程式 _______________________________ 。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________ 。
(2)NaHCO3溶液与硫酸铝溶液混合的
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=
您最近一年使用:0次
2018-11-17更新
|
424次组卷
|
2卷引用:【全国百强校】山东省师范大学附属中学2018-2019学年高二上学期第五次学分认定(期中)考试化学试题
11-12高三上·山东潍坊·阶段练习
6 . 碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1) NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L-1的氨水,溶液中随着水量的增加而减小的是_____________ (填序号)
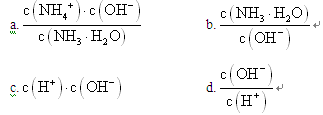
(2)将1.12LCO2(标准状况)通入100mL1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为_________________________________________________ ;
①c(OH-)=2c(H2CO3)+______________________________________________ ;
②c(H+)+c(Na+)=___________________________________________________ 。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2===CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则原电池工作时电解质溶液中向正极移动的离子是_____________ 。
(1) NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L-1的氨水,溶液中随着水量的增加而减小的是
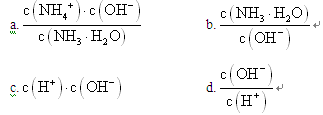
(2)将1.12LCO2(标准状况)通入100mL1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
①c(OH-)=2c(H2CO3)+
②c(H+)+c(Na+)=
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2===CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则原电池工作时电解质溶液中向正极移动的离子是
您最近一年使用:0次



