名校
解题方法
1 . 醋酸钠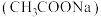 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。
(1)配制 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,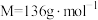 )的质量为
)的质量为_______ 。实验需要的仪器有天平、药匙、玻璃棒、量筒、_______ (从下列图中选择,写出名称)。 水解程度的影响。
水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为 ):
):
i.实验_______ 和_______ (填序号),探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3,探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4,探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_______ 。
②实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据_______ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测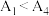 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是_______ 。
(3)小组通过测定不同温度下 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。
查阅资料: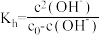 ,
, 为
为 溶液起始浓度。
溶液起始浓度。
试剂: 溶液、
溶液、 盐酸、
盐酸、 计。
计。
实验:测定40℃下 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。
在50℃和60℃下重复上述实验。
数据处理:40℃,
_______ (用含 、
、 、
、 的计算式表示)
的计算式表示)
实验结论: ,温度升高,促进
,温度升高,促进 水解。
水解。
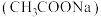 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。(1)配制
 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,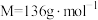 )的质量为
)的质量为
 水解程度的影响。
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
 ):
):i.实验
 水解程度的影响;
水解程度的影响;ii.实验1和3,探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4,探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 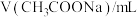 |  | 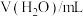 |  |
| 1 | 25℃ | 40.0 | 0 | 0 |  |
| 2 | 25℃ | 4.0 | 0 | 36.0 |  |
| 3 | 25℃ | 20.0 | 10.0 |  |  |
| 4 | 40℃ | 40.0 | 0 | 0 |  |

②实验测得
 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测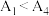 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是(3)小组通过测定不同温度下
 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。查阅资料:
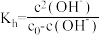 ,
, 为
为 溶液起始浓度。
溶液起始浓度。试剂:
 溶液、
溶液、 盐酸、
盐酸、 计。
计。实验:测定40℃下
 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。| 序号 | 实验 | 记录的数据 |
| 5 | 取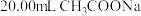 溶液,用 溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为 |
| 6 | 测40℃纯水的 |  |
| 7 |  |
数据处理:40℃,

 、
、 、
、 的计算式表示)
的计算式表示)实验结论:
 ,温度升高,促进
,温度升高,促进 水解。
水解。
您最近一年使用:0次
2023-03-16更新
|
2405次组卷
|
5卷引用:广东省广州市2023届高三一模考试化学试题
广东省广州市2023届高三一模考试化学试题(已下线)专题19 实验综合题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(实验综合题)广东省广州市2022-2023学年高三普通高中毕业班综合测试(一)化学试题 广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题
2 . 均苯三甲酸是一种重要的有机三元弱酸,可表示为 。向
。向 的
的 溶液中加入
溶液中加入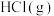 或
或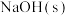 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:
已知:①[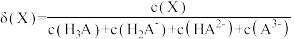 ,X为
,X为 、
、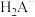 、
、 或
或 ]
]
②(
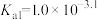 、
、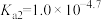 、
、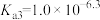 )
)
 。向
。向 的
的 溶液中加入
溶液中加入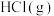 或
或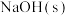 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:已知:①[
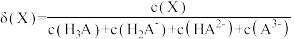 ,X为
,X为 、
、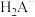 、
、 或
或 ]
]②(

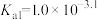 、
、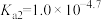 、
、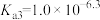 )
)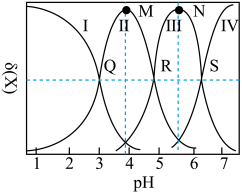
A.若用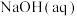 滴定 滴定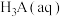 至恰好生成 至恰好生成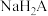 ,可选甲基橙做指示剂 ,可选甲基橙做指示剂 |
B.N点的 |
C.常温下,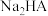 的水解常数 的水解常数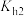 的数量级为 的数量级为 |
D.R点满足: |
您最近一年使用:0次
2022-11-25更新
|
1559次组卷
|
6卷引用:广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题1-16)
3 . 常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、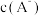 、
、 、
、 的负对数
的负对数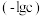 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、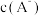 、
、 、
、 的负对数
的负对数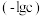 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示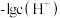 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在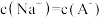 |
C.常温下,将A点对应溶液加水稀释,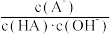 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: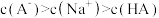 |
您最近一年使用:0次
2022-03-31更新
|
2750次组卷
|
6卷引用:广东省2021-2022学年高三下学期一模化学试题
广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)湖北省2022届高三5月联考化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题
4 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中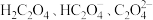 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
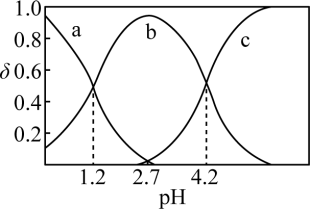
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中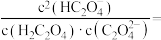
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③ 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中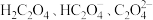 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中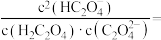
②pH从1.2增大至4.2的过程中,水的电离程度
③
 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:广东省湛江市2021-2022学年高二上学期期末调研考试化学试题
5 . 氮及其化合物在生产、生活与环境中有着重要研究和应用价值。根据要求回答问题:
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=_______ kJ·mol-1
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)_______ (填“增大”、“不变”或“减小”)
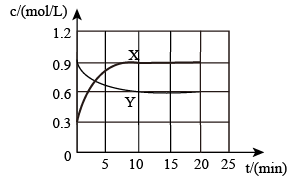
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=_______ mol/(L·s)
③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=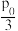 ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=_______ ,保持温度不变,再向密闭容器中充入nmolN2O4,维持总压强为2p0,则在该温度下该反应的压强平衡常数(Kp)=_______ (用各气体物质的分压代替浓度的平衡常数叫压强平衡常数(Kp)。分压=总压×物质的量分数)
(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
①pH=9时溶液中c(N )
)_______ c(R+)(填“>”、“=”或“<”),pH=a时溶液中c(HN3)_______ c(N )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)
②HN3的Ka=_______ (精确值)
(4)N2O5是一种新型硝化剂。其制备装置如图所示。
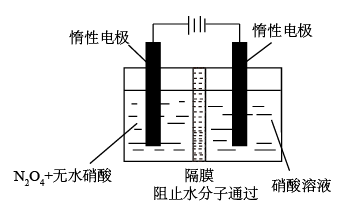
透过隔膜的粒子是_______ ,制取N2O5的电极反应式为_______
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=

③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=
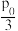 ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
| V(HN3)/mL | 0 | 12.50 | 12.75 | 25.00 |
| pH | 13 | 9 | 7 | a |
 )
) )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)②HN3的Ka=
(4)N2O5是一种新型硝化剂。其制备装置如图所示。

透过隔膜的粒子是
您最近一年使用:0次



