1 . 根据表中数据判断,下列选项结论正确的是
| 酸 | H2C2O4 | HCN | H2CO3 |
| 电离常数(25℃) | K1=5.6×10-2 K1=1.5×10-4 | K=6.2×10-10 | K1=4.5×10-7 K2=4.4×10-11 |
| A.NaCN+H2O+CO2(少量)=HCN+Na2CO3 |
| B.0.1mol/L的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,无明显现象,说明无反应 |
C.浓度均为 的Na2CO3、NaHCO3、NaCN、 的Na2CO3、NaHCO3、NaCN、 溶液,pH最大的是Na2CO3 溶液,pH最大的是Na2CO3 |
D. 溶液呈酸性,溶液中离子浓度由大到小的顺序是 溶液呈酸性,溶液中离子浓度由大到小的顺序是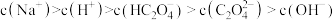 |
您最近一年使用:0次
2 . 常温下,弱酸HA与弱碱MOH分别用强碱或强酸调节pH时,HA、A—、MOH和M+的分布分数δ(X)与溶液pH的关系如图所示。
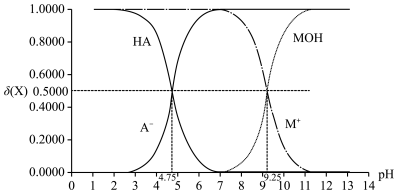
已知:以HA分子为例,存在δ(HA)= ]。下列说法正确的是
]。下列说法正确的是

已知:以HA分子为例,存在δ(HA)=
 ]。下列说法正确的是
]。下列说法正确的是| A.MA溶液中水的电离程度高于纯水 |
| B.MOH的电离常数Kb(MOH)=10-9.25 |
| C.等物质的量浓度的HA和NaA的混合溶液中pH>7 |
| D.pH=7的HA与NaOH的混合溶液及HA与MOH的混合溶液中δ(HA)后者大于前者 |
您最近一年使用:0次
2022-01-22更新
|
732次组卷
|
4卷引用:广东省肇庆市2021-2022学年高三第二次模拟考试化学试题
名校
解题方法
3 . 已知:25℃时,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。用0.01 mol/L的CH3COOH溶液滴定20 mL由浓度均为0.01 mol/L的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是
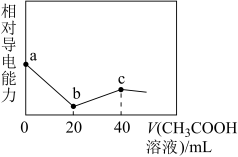
A.a点时混合溶液中:c( )≈1.7×10-5 mol·L-1 )≈1.7×10-5 mol·L-1 |
B.b点时混合溶液中:c(CH3COOH)<c( ) ) |
C.c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+) )+c(NH3·H2O)+c(Na+) |
| D.c点时混合溶液中:pH=7 |
您最近一年使用:0次
2021-05-13更新
|
956次组卷
|
11卷引用:广东省肇庆市百花中学2021届高三下学期5月模拟考试化学试题
广东省肇庆市百花中学2021届高三下学期5月模拟考试化学试题福建省莆田市2021届高三第三次质量检测化学试题辽宁省朝阳市2021届高三第三次模拟考试化学试题山东省泰安市与济南章丘区2021届高三5月联合模拟考试化学试题山西省2020-2021学年高二下学期5月考试化学试题湖南省长沙市明德中学2021届高三下学期第三次模拟考试化学试题湖北省十堰市2020-2021学年高二下学期期末调研考试化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练湖南省汨罗市第二中学2021-2022学年高三下学期4月月考化学试题2024届重庆市高三下学期二模考试化学试题陕西省西安市5校联考2023-2024学年高二上学期1月期末化学试题
名校
4 .  时,
时, 的
的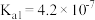 ,
,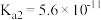 ,室温下向10mL
,室温下向10mL 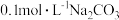 溶液中逐滴加入
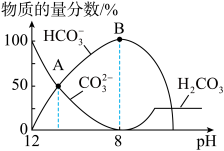
溶液中逐滴加入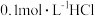 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象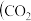 因有逸出未画出
因有逸出未画出 。下列说法错误的是
。下列说法错误的是
 时,
时, 的
的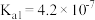 ,
,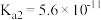 ,室温下向10mL
,室温下向10mL 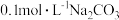 溶液中逐滴加入
溶液中逐滴加入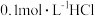 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象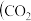 因有逸出未画出
因有逸出未画出 。下列说法错误的是
。下列说法错误的是
A.A点所示溶液的 |
B.B点所示溶液: |
C.A点 点发生反应的离子方程式为 点发生反应的离子方程式为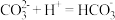 |
D.分步加入酚酞和甲基橙,用滴定法可测定 与 与 混合物的组成 混合物的组成 |
您最近一年使用:0次
2020-01-27更新
|
271次组卷
|
6卷引用:广东省肇庆市2019届高三下学期第二次统一检测理科综合化学试题
解题方法
5 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2 (g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
则CO与H2反应生成CH4(g)和H2O(g)的热化学方程式为 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液,则该反应的化学方程式为 。
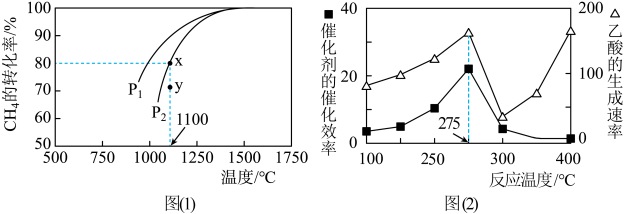
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g) 。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图(1)所示,则压强P1 P2(填“>”或“<”);压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”);写出X点对应温度下的该反应的平衡常数计算式K= (不必计算出结果)。
2CO(g)+2H2(g) 。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图(1)所示,则压强P1 P2(填“>”或“<”);压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”);写出X点对应温度下的该反应的平衡常数计算式K= (不必计算出结果)。
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图(2)所示。在275~400℃之间,乙酸的生成速率先降低后升高的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是(写一条) 。
③乙酸(用HAc表示)电离方程式为HAc H++Ac-,电离常数用Ka表示;乙酸根的水解方程式为Ac-+H2O
H++Ac-,电离常数用Ka表示;乙酸根的水解方程式为Ac-+H2O  OH-+ HAc,水解常数用Kh表示,则Kh= (用Ka和水的离子积KW表示)。
OH-+ HAc,水解常数用Kh表示,则Kh= (用Ka和水的离子积KW表示)。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
已知: CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1C(s)+2H2 (g)
 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-12CO(g)
 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1则CO与H2反应生成CH4(g)和H2O(g)的热化学方程式为 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液,则该反应的化学方程式为 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g) 。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图(1)所示,则压强P1 P2(填“>”或“<”);压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”);写出X点对应温度下的该反应的平衡常数计算式K= (不必计算出结果)。
2CO(g)+2H2(g) 。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图(1)所示,则压强P1 P2(填“>”或“<”);压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”);写出X点对应温度下的该反应的平衡常数计算式K= (不必计算出结果)。
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图(2)所示。在275~400℃之间,乙酸的生成速率先降低后升高的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是(写一条) 。
③乙酸(用HAc表示)电离方程式为HAc
 H++Ac-,电离常数用Ka表示;乙酸根的水解方程式为Ac-+H2O
H++Ac-,电离常数用Ka表示;乙酸根的水解方程式为Ac-+H2O  OH-+ HAc,水解常数用Kh表示,则Kh= (用Ka和水的离子积KW表示)。
OH-+ HAc,水解常数用Kh表示,则Kh= (用Ka和水的离子积KW表示)。
您最近一年使用:0次



