名校
1 . 下列物质① 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液
(1)属于非电解质的是:___________ ;属于强电解质的是:___________ ;属于弱电解质的是:___________ ;既不是电解质也不是非电解质,常温下能导电的物质是___________ (均填序号)。
(2)写出①的电离方程式___________ 。
(3)向⑦的溶液中滴加几滴浓盐酸,平衡___________ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中
___________ (填“增大”、“减小”或者“不变”),
___________ (填“增大”、“减小”或者“不变”)。
(4)将 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是___________ (结合有关离子方程式说明)。
(5)将标准状况下2.24L⑥缓慢通入 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系___________ 。
(6)将足量⑥缓慢通入 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度___________ 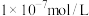 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH___________ (填“增大”、“减小”、或“不变”)。
 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液(1)属于非电解质的是:
(2)写出①的电离方程式
(3)向⑦的溶液中滴加几滴浓盐酸,平衡


(4)将
 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是(5)将标准状况下2.24L⑥缓慢通入
 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系(6)将足量⑥缓慢通入
 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度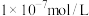 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH
您最近一年使用:0次
名校
2 .  溶液在稀释过程中,溶液中逐渐增大的量是
溶液在稀释过程中,溶液中逐渐增大的量是
① ②
② ③pH ④
③pH ④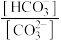
 溶液在稀释过程中,溶液中逐渐增大的量是
溶液在稀释过程中,溶液中逐渐增大的量是①
 ②
② ③pH ④
③pH ④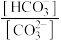
| A.①③ | B.①④ | C.②③ | D.②④ |
您最近一年使用:0次
2023-11-06更新
|
498次组卷
|
6卷引用:上海市上海中学2022-2023学年高二上学期期中考试化学试题
上海市上海中学2022-2023学年高二上学期期中考试化学试题上海市新中高级中学2023-2024学年高二下学期阶段检测化学试题 【精品卷】3.3.2 影响盐类水解的主要因素课堂例题-人教版2023-2024学年选择性必修1(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河北省高碑店市崇德实验中学2023-2024学年高二上学期期中考试化学试题 陕西省兴平市南郊高级中学2023-2024学年高二上学期第三次化学质量检测题
3 . 冰壶比赛称为“冰上的国际象棋”,制作冰壶用的标准砥石的化学成分为石英碱长正长岩,常见的组分有钾长石K[AlSi3O8]和钠长石Na[AlSi3O8]等。完成下列填空:
(1)上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是_______ ,原子核外有两个未成对电子的元素有_______ 。
(2)用一个化学方程式比较钠和铝的金属性的强弱_______ ,并用原子结构知识的观点解释原因_______ 。
(3)我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式_______ 。
______Al+_______K[AlSi3O8]+_______AlCl3→_______Si+_______AlOCl+_______KAlO2;
上述反应中若产生14g硅,转移的电子数为_______ 。
(4)KAlO2溶液中,n(K+)_______ n(AlO )(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因_______ 。
(1)上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是
(2)用一个化学方程式比较钠和铝的金属性的强弱
(3)我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式
______Al+_______K[AlSi3O8]+_______AlCl3→_______Si+_______AlOCl+_______KAlO2;
上述反应中若产生14g硅,转移的电子数为
(4)KAlO2溶液中,n(K+)
 )(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
您最近一年使用:0次
名校
解题方法
4 . 对于0.1mol/LNa2SO3溶液,正确的是
| A.升高温度,溶液的pH降低 |
B.加入少量NaOH固体,c( )与c(Na+)均增大 )与c(Na+)均增大 |
C.c(Na+)+c(H+)=2c( )+2c( )+2c( )+c(OH-) )+c(OH-) |
D.c(Na+)=2c( )+c( )+c( )+c(H2SO3) )+c(H2SO3) |
您最近一年使用:0次
2022-01-05更新
|
318次组卷
|
3卷引用:上海市吴淞中学2022-2023学年高三上学期期中考试化学试题
上海市吴淞中学2022-2023学年高三上学期期中考试化学试题(已下线)专题20 用守恒思想破解溶液中粒子浓度大小的比较-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)黑龙江省哈尔滨市第一六二中学2021-2022学年高三上学期第三次月考化学试题
5 . 关于联合制碱法的说法正确的是
| A.原料CO2来自石灰石分解 | B.向母液中通入NH3可抑制NH 水解 水解 |
| C.循环利用NH3 | D.将母液蒸发结晶析出NH4Cl |
您最近一年使用:0次
6 . 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是
 )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是A.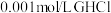 水溶液的 水溶液的 |
B.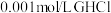 水溶液加水稀释, 水溶液加水稀释, 升高 升高 |
C. 在水中的电离方程式为: 在水中的电离方程式为: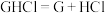 |
D. 水溶液中: 水溶液中: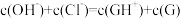 |
您最近一年使用:0次
2021-06-11更新
|
10404次组卷
|
44卷引用:上海市曹杨中学2021-2022 学年高三下学期期中考试化学试题
上海市曹杨中学2021-2022 学年高三下学期期中考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)天津市南开区2022届高三一模化学试题福建省泉州市泉港一中、厦门外国语石狮分校2021-2022学年高二下学期期中联考化学试题(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)浙江省杭州高级中学2022-2023学年高三上学期模拟考试化学试题广东省深圳市龙华区2021-2022学年高二上学期期末学业质量监测化学试题2021年新高考广东化学高考真题山东省淄博市2020-2021学年高二下学期期末考试化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)2021年广东省高考化学试卷变式题1-10题(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)浙江省吴兴高级中学2021-2022学年高二上学期12月月考化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第49讲 盐类的水解甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题重庆市长寿区2022-2023学年高二上学期期末质量检测化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第4讲 盐类的水解广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题天津市耀华中学2023-2024学年高二上学期11月期中化学试题陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题湖北省武汉市育才高级中学等2校2023-2024学年高二上学期化学模拟试卷2024届广东省高州市第一中学高三下学期5月考前热身训练化学试题
7 . 测定0.1 mol/L Na2SO3溶液先升温再降温过程中的pH,数据如下:
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
| 时刻 | ① | ② | ③ | ④ |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
下列说法不正确的是
A.Na2SO3溶液中存在水解平衡: +H2O +H2O  +OH− +OH− |
B.④的pH与①不同,是由于 浓度增大造成的 浓度增大造成的 |
| C.①→③的过程中,水的电离程度变大 |
| D.①与④的Kw值相等 |
您最近一年使用:0次
8 . 煤炭是我国最主要能源。煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K= ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:___________ ,若该反应只有在持续高温下才能自发进行 则该反应为___________ (“吸热”或“放热”)反应。
(2) 将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:
①实验1中以v(CO2)表示的反应速率为___________ 。
②900 ℃时,反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数
CO2(g)+H2(g)的平衡常数___________ 。向实验2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,平衡___________ (选填“正反应方向”、“逆反应方向”或“不”)移动。
(3)将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
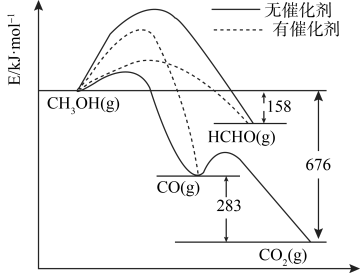
①在有催化剂作用下,CH3OH与O2反应主要生成___________ (填“CO”、“CO2”或HCHO”)。请补全热化学方程式HCHO(g)+1/2O2(g)→CO(g)+H2O(g)___________ 。
②HCHO可进一步被氧化为重要工业原料 HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化__________ 。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=
 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:(2) 将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
②900 ℃时,反应CO(g)+H2O(g)
 CO2(g)+H2(g)的平衡常数
CO2(g)+H2(g)的平衡常数(3)将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。

①在有催化剂作用下,CH3OH与O2反应主要生成
②HCHO可进一步被氧化为重要工业原料 HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化

您最近一年使用:0次
名校
解题方法
9 . 25℃,相同体积相同浓度的盐酸能与下列溶液恰好完全中和。①V1mLpH=9的氨水;②V2mLpH=10的氨水;③V3mLpH=10的NaOH溶液。下列叙述正确的是
| A.V1<10V2 | B.①和②中 比值:①<② 比值:①<② |
| C.①、②、③中水的电离度:②=③>① | D.分别与盐酸完全中和后溶液的pH:③>①>② |
您最近一年使用:0次
2020-12-26更新
|
973次组卷
|
3卷引用:上海市第二中学2021-2022学年高二下学期(等级班)期末考试化学试题
名校
解题方法
10 . 向氯化铵溶液加入少量试剂M,使溶液中c( )=c(Cl-)。试剂M不可能是
)=c(Cl-)。试剂M不可能是
 )=c(Cl-)。试剂M不可能是
)=c(Cl-)。试剂M不可能是| A.氨水 | B.稀盐酸 | C.硝酸银溶液 | D.硫酸铵溶液 |
您最近一年使用:0次
2020-12-23更新
|
199次组卷
|
3卷引用:上海外国语大学附属大境中学2022-2023学年高三上学期12月月考化学试题



