名校
1 . 已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
(1)已知某浓度的 水溶液
水溶液 ,原因是
,原因是_______ (用离子方程式表示), 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度为
浓度为_______ 。
(2)同浓度 这4种溶液中碱性由强到弱的顺序是
这4种溶液中碱性由强到弱的顺序是_______ ; 溶液中各离子浓度由大到小的顺序是
溶液中各离子浓度由大到小的顺序是_______ 。
(3)体积相同、 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.
;b. ;c.
;c. 分别与同浓度的
分别与同浓度的 溶液完全中和,消耗
溶液完全中和,消耗 溶液的体积由大到小的排列顺序是(填字母)
溶液的体积由大到小的排列顺序是(填字母)_______ 。
| 弱酸 |  |  |  |
电离平衡常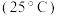 | 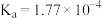 |  | 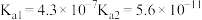 |
 水溶液
水溶液 ,原因是
,原因是 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度为
浓度为(2)同浓度
 这4种溶液中碱性由强到弱的顺序是
这4种溶液中碱性由强到弱的顺序是 溶液中各离子浓度由大到小的顺序是
溶液中各离子浓度由大到小的顺序是(3)体积相同、
 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.
;b. ;c.
;c. 分别与同浓度的
分别与同浓度的 溶液完全中和,消耗
溶液完全中和,消耗 溶液的体积由大到小的排列顺序是(填字母)
溶液的体积由大到小的排列顺序是(填字母)
您最近一年使用:0次
2022-04-04更新
|
79次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2021-2022学年高二上学期期末考试化学试题
2 . NA为阿伏加 德罗常数的值,下列说法不正确 的是( )
| A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA |
| B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA |
| C.含7.8gNa2S的溶液中阴离子总数大于0.1NA |
| D.向100mL1mol•L-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA |
您最近一年使用:0次
2020-06-09更新
|
819次组卷
|
5卷引用:新疆维吾尔自治区和田地区洛浦县2022-2023学年高三上学期11月期中考试化学试题
新疆维吾尔自治区和田地区洛浦县2022-2023学年高三上学期11月期中考试化学试题浙江省温州市2020年4月份普通高中选考适应性测试(二模)化学试题模拟卷05(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
3 . 请你利用所学的化学反应原理解决下列问题:
(1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是__________ 。
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式____________________________
(3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)=__________ ,该盐酸与0.04mol/L的Ba(OH)2等体积混合,混合后的pH值________
(4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是__________________
(5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
A. 写出AgCl沉淀溶解平衡方程式______________________
B. ③中颜色变化说明Ksp(AgCl)____ Ksp(AgI)(填“>”、“<”、“=”)
(1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式
(3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)=
(4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是
(5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
A. 写出AgCl沉淀溶解平衡方程式
B. ③中颜色变化说明Ksp(AgCl)
您最近一年使用:0次
2018-01-03更新
|
574次组卷
|
4卷引用:新疆哈密市第八中学2020-2021学年高二上学期期末考试化学试题



