名校
解题方法
1 . 已知液氨的电离类似水的电离,碳酸钠在液氨中完全电离并发生类似水解的氨解。肼( )为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
)为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
 )为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
)为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是A.元素的电负性: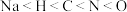 |
B.肼在水中第一步电离的方程式为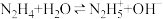 |
C.肼与硫酸反应生成的酸式盐中阳离子的电子式为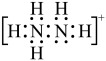 |
D.碳酸钠在液氨中第一步氨解的离子方程式为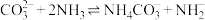 |
您最近一年使用:0次
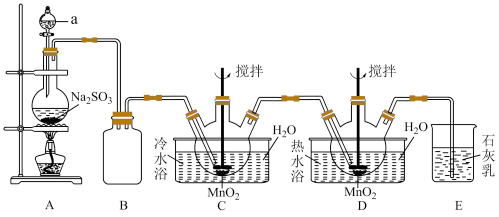
2 . 连二硫酸锰(MnS2O6)常用于灭菌以及水果、蔬菜的保鲜。硫酸锰(MnSO4)是重要的微量元素肥料之一,也用作饲料添加剂,在涂料、造纸、陶瓷、电子、纺织等领域也有广泛应用。利用MnO2悬浊液吸收SO2气体制取MnS2 O6和MnSO4的装置如图所示(部分夹持仪器、加热仪器未画出)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为___________ ,该仪器中装入的试剂最好为___________ (填标号)。
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置___________ (填标号)中生成,装置B的作用为___________ 。
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为___________ 。
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是___________ 。
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。___________ 。(填标号)
A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将___________ (填“偏大”“偏小”或“无影响”)。
③产品中锰的质量分数是___________ (列出计算式)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。

A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将
③产品中锰的质量分数是
您最近一年使用:0次
2023-09-14更新
|
232次组卷
|
2卷引用:重庆市江北区2023-2024学年高三下学期模拟测试化学试题(七)
3 . 25℃时,向0.10 元弱酸
元弱酸 溶液逐滴滴入NaOH溶液,溶液中的
溶液逐滴滴入NaOH溶液,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数 随pH的变化如图所示[已知
随pH的变化如图所示[已知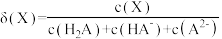 ];
];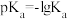 。下列叙述错误的是
。下列叙述错误的是

 元弱酸
元弱酸 溶液逐滴滴入NaOH溶液,溶液中的
溶液逐滴滴入NaOH溶液,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数 随pH的变化如图所示[已知
随pH的变化如图所示[已知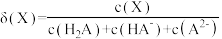 ];
];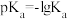 。下列叙述错误的是
。下列叙述错误的是
A. , , |
B. 时, 时,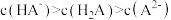 |
C.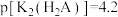 |
D. 时, 时,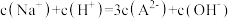 |
您最近一年使用:0次
2021-11-08更新
|
746次组卷
|
5卷引用:重庆市杨家坪中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
4 . 室温下,下列实验过程能达到预期目的的是
| 选项 | 实验过程 | 实验目的 |
| A | 向 NaCl、NaI 的混合溶液中滴加少量 AgNO3 溶液,生成淡黄色沉淀 | 证明 Ksp(AgCl)> Ksp(AgI) |
| B | 相同条件下,分别用 pH 试纸测定0.1 mol/LNaClO 溶液、0.1mol/LCH3COONa 溶液的 pH | 比较HClO 和 CH3COOH 的酸性强弱 |
| C | 苯和液溴的混合液中加入铁粉,将产生的气体通入硝酸酸化的AgNO3 溶液中,产生淡黄色沉淀 | 证明苯与液溴在Fe 催化下发生取代反应 |
| D | 向 NaAlO2 溶液中加入NaHCO3 溶液,观察到有白色沉淀生成 | 证明AlO 得质子的能力强于CO 得质子的能力强于CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-08更新
|
961次组卷
|
3卷引用:重庆市第一中学2021届高三下学期第二次月考(4月)化学试题
解题方法
5 . 无水氯化铁是一种重要的化工原料,其熔点为306℃,沸点为315℃,极易潮解。工业制备氯化铁的一种工艺如下:

回答下列各题:
(1)向沸水中滴入几滴饱和氯化铁溶液,煮沸至溶液变为红褐色,该过程可用离子方程式表示为________________ 。
(2)由FeCl3·6H2O获得无水氯化铁的方法是_________ 。
(3) “氯化”时,若温度超过400℃产物中存在相对分子质量为325的物质,该物质的化学式为_______________ 。
(4)吸收塔内盛放的吸收剂为____________ 。
(5)某兴趣小组仿照工业制备无水氯化铁,设计如下实验:

①装置C中玻璃丝的作用为_____________ ;
②该实验设计存在的明显缺陷为_______________ ;
③通过下列实验测定实验后所得固体中FeCl3的质量分数。
a.称取mg所得固体,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;
b.取出10mL待测溶液液于锥形瓶中,加入稍过量的KI溶液充分反应;
c.以淀粉做指示剂,用bmol/LNa2S2O3溶液滴定(I2+2Na2S2O3=Na2S4O6+2NaI),共用去VmL。
通过上述实验测得所得固体中氯化铁的质量分数为_____________ ;若加入淀粉偏多,可能导致最终结果______ (填“偏大”“偏小”或“无影响”)。

回答下列各题:
(1)向沸水中滴入几滴饱和氯化铁溶液,煮沸至溶液变为红褐色,该过程可用离子方程式表示为
(2)由FeCl3·6H2O获得无水氯化铁的方法是
(3) “氯化”时,若温度超过400℃产物中存在相对分子质量为325的物质,该物质的化学式为
(4)吸收塔内盛放的吸收剂为
(5)某兴趣小组仿照工业制备无水氯化铁,设计如下实验:

①装置C中玻璃丝的作用为
②该实验设计存在的明显缺陷为
③通过下列实验测定实验后所得固体中FeCl3的质量分数。
a.称取mg所得固体,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;
b.取出10mL待测溶液液于锥形瓶中,加入稍过量的KI溶液充分反应;
c.以淀粉做指示剂,用bmol/LNa2S2O3溶液滴定(I2+2Na2S2O3=Na2S4O6+2NaI),共用去VmL。
通过上述实验测得所得固体中氯化铁的质量分数为
您最近一年使用:0次
名校
6 . 下列操作能达到预期目的是
| 选项 | 操作内容 | 操作目的 |
| A | 室温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaClO溶液和CH3COOH溶液的pH | 比较HClO和 CH3COOH的酸性强弱 |
| B | 将FeCl2溶于稀盐酸中,并加入适量铁粉 | 配制FeCl2溶液 |
| C | 常温下,测得饱和溶液的pH:NaA>NaB | 证明水解程度:A— > B— |
| D | 常温下,等体积pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HB是强酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 请你利用所学的化学反应原理解决下列问题:
(1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是__________ 。
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式____________________________
(3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)=__________ ,该盐酸与0.04mol/L的Ba(OH)2等体积混合,混合后的pH值________
(4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是__________________
(5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
A. 写出AgCl沉淀溶解平衡方程式______________________
B. ③中颜色变化说明Ksp(AgCl)____ Ksp(AgI)(填“>”、“<”、“=”)
(1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式
(3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)=
(4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是
(5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
A. 写出AgCl沉淀溶解平衡方程式
B. ③中颜色变化说明Ksp(AgCl)
您最近一年使用:0次
2018-01-03更新
|
574次组卷
|
4卷引用:重庆市巫溪县中学校2017-2018学年高二上学期第二次月考化学试题



