2023·河南安阳·三模
名校
1 . 某化学实验小组设计如下实验探究Zn与溶液中Fe3+发生反应的原理。
下列说法错误的是
| 实验 | 试剂 | 现象 |
| I | 2 mL0.1 mol· L-1FeCl3溶液、过量锌粉 | 黄色溶液很快变浅,接着有无色气泡产生,固体中未检出铁单质 |
| Ⅱ | 2 mL1 mol· L-1FeCl3溶液(pH≈0.70)、过量锌粉 | 很快有大量气体产生,出现红褐色浑浊,30 min左右产生红褐色沉淀,溶液颜色变浅,产生少量铁单质 |
| A.实验I说明Fe3+被还原为Fe2+ |
| B.可用酸性高锰酸钾溶液检验实验I得到的溶液中含有Fe2+ |
| C.实验Ⅱ发生了置换反应和复分解反应 |
| D.实验说明Fe3+、H+与Zn的反应与离子浓度有关 |
您最近一年使用:0次
2023-05-23更新
|
1488次组卷
|
11卷引用:选择题6-10
(已下线)选择题6-10河南省安阳市2023届高三下学期第三次模拟考试理科综合化学试题(已下线)【知识图鉴】单元讲练测必修第一册第三单元02基础练(已下线)第6讲 铁及其重要化合物(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题06 元素及其化合物 -2023年高考化学真题题源解密(新高考专用)辽宁省沈阳市第一二〇中学2023-2024学年高三上学期第一次质量检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五高级中学(前郭五中)2023-2024学年高三上学期第三次考试 化学试卷 (已下线)热点19 化学微型实验(已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题
名校
2 . 常温下, 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是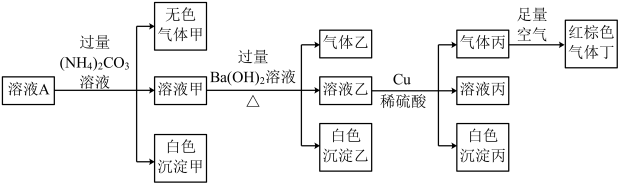
A.溶液A中一定含有 、 、 、 、 、 、 |
B.若实验消耗 14.4g,则生成气体丁的体积为3.36L 14.4g,则生成气体丁的体积为3.36L |
C.沉淀乙中一定有 ,可能有 ,可能有 |
D.溶液A中一定没有 ,但是无法确定是否含有 ,但是无法确定是否含有 |
您最近一年使用:0次
2023-02-08更新
|
240次组卷
|
17卷引用:河北省定州中学2018届高三(承智班)下学期开学考试化学试题
河北省定州中学2018届高三(承智班)下学期开学考试化学试题河南省豫南豫北名校2018届高三精英联赛化学试题1江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题(已下线)黄金30题系列 高三化学 小题易丢分陕西省陕师大附中2018届高三第五次月考化学试题河南省南阳市第一中学校2018届高三第七次考试理综化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2西藏自治区拉萨中学2018届高三第六次月考理综化学试题湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题安徽省名校2020-2021学年高二下学期5月第二次联考化学试题陕西省西安中学2021-2022学年高三上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖南省常德市第一中学 2023届高三7月摸底考试化学试题(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)学科特色6 离子推断湖南省永州市祁阳县第四中学2023-2024学年高三上学期第三次段考化学试题
名校
3 . 下列说法正确的是
| A.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s),能自发进行,则△H>0 |
| B.Al2(SO4)3溶液蒸干所得固体产物为Al(OH)3 |
| C.已知工业上常用NH4Cl溶液给金属除锈,则温度降低会使除锈效果减弱 |
| D.pH相同的盐酸和醋酸溶液与足量锌粒反应,产生相同质量的H2,则盐酸溶液的体积小于醋酸溶液的体积 |
您最近一年使用:0次
2021-09-23更新
|
502次组卷
|
4卷引用:河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题
名校
解题方法
4 . 碳酸锂在医疗上可用于治疗狂躁性精神病,作镇静剂等。电解铝废渣(主要含AlF3、LiF、NaF、CaO等)可用于制备Li2CO3。

已知:①20℃时,Ksp[Ca3(PO4)2]=2×10-29,Ksp(CaHPO4)=1×10-7,Ksp(CaSO4)=5×10-5。
②CaF2可溶于硫酸。
③Li2CO3的溶解度:0℃1.54g,20℃1.33g,80℃0.85g。
(1)在加热条件下“酸浸”,反应生成能腐蚀玻璃的气体,写出“酸浸”中AlF3发生反应的化学方程式:__ 。
(2)“滤渣”的主要成分是__ (填化学式)。
(3)“转化”后所得的LiHCO3溶液中含有的Ca2+需要加入Li3PO4稀溶液除去。“除钙”步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如图1所示。
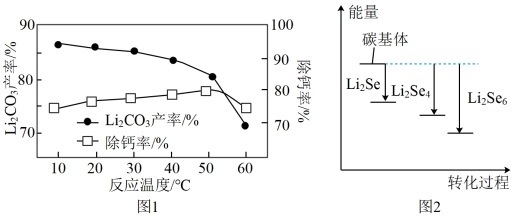
①随着温度的升高,Li2CO3的产率逐渐减小的原因是__ 。
②当温度高于50℃时,除钙率下降的原因可能是__ 。
(4)热分解后,获得Li2CO3的操作是先加热蒸发,然后__ 。
(5)锂硒电池是新一代全固态锂二次电池,具有优异的循环稳定性,其正极材料为附着硒化锂(Li2Sex)的碳基体。Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是__ 。
(6)对电解铝废水中Al3+含量的测定和处理是环境保护的重要课题。工业上常采用EDTA络合滴定法测定电解铝废水中的Al3+含量:取10.00mL电解铝废水置于250mL锥形瓶中,加入一定体积的柠檬酸,煮沸;再加入0.005mol·L-1的EDTA标准液20.00mL,调节溶液的pH至4.0,加热,冷却后用0.002mol·L-1的CuSO4标准液滴定至终点,消耗CuSO4标准液30.00mL。该矿业废水中Al3+的含量为___ mg·L-1。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1:1)

已知:①20℃时,Ksp[Ca3(PO4)2]=2×10-29,Ksp(CaHPO4)=1×10-7,Ksp(CaSO4)=5×10-5。
②CaF2可溶于硫酸。
③Li2CO3的溶解度:0℃1.54g,20℃1.33g,80℃0.85g。
(1)在加热条件下“酸浸”,反应生成能腐蚀玻璃的气体,写出“酸浸”中AlF3发生反应的化学方程式:
(2)“滤渣”的主要成分是
(3)“转化”后所得的LiHCO3溶液中含有的Ca2+需要加入Li3PO4稀溶液除去。“除钙”步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如图1所示。

①随着温度的升高,Li2CO3的产率逐渐减小的原因是
②当温度高于50℃时,除钙率下降的原因可能是
(4)热分解后,获得Li2CO3的操作是先加热蒸发,然后
(5)锂硒电池是新一代全固态锂二次电池,具有优异的循环稳定性,其正极材料为附着硒化锂(Li2Sex)的碳基体。Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是
(6)对电解铝废水中Al3+含量的测定和处理是环境保护的重要课题。工业上常采用EDTA络合滴定法测定电解铝废水中的Al3+含量:取10.00mL电解铝废水置于250mL锥形瓶中,加入一定体积的柠檬酸,煮沸;再加入0.005mol·L-1的EDTA标准液20.00mL,调节溶液的pH至4.0,加热,冷却后用0.002mol·L-1的CuSO4标准液滴定至终点,消耗CuSO4标准液30.00mL。该矿业废水中Al3+的含量为
您最近一年使用:0次
2021-03-03更新
|
1174次组卷
|
6卷引用:河北省五个一联盟2022-2023学年高三上学期12月联考化学试题
河北省五个一联盟2022-2023学年高三上学期12月联考化学试题河南省新乡市2021届高三2月一轮复习摸底考试理综化学试题广东省湛江市2021届高三下学期3月普通高考测试(一)化学试题贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题(已下线)03 无机化工流程题(3) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)广东省茂名市高州市第一中学2021届高三下学期3月月考化学试题
名校
5 . 25 ℃时,0.1 mol/LR2SO4溶液加水稀释,混合溶液中 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
| A.Kb(ROH)的数量级为10-6 |
| B.P、Q点对应溶液中c(H+ )的值:P<Q |
C.若将溶液无限稀释,溶液中c(R+ )≈2c(SO ) ) |
| D.相同条件下,若改为c(R2SO4)=0.2 mol/L,P点移至W点 |
您最近一年使用:0次
名校
6 . 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
| 编号 | Ⅰ | Ⅱ |
实验 |  |  |
| 现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
| A.Na2SiO3溶液一定显碱性 |
| B.由Ⅰ能说明酸性H2CO3>H2SiO3 |
| C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液 |
| D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓ |
您最近一年使用:0次
2020-05-23更新
|
512次组卷
|
3卷引用:河北省实验中学2021届高三上学期第一次月考化学试题
名校
7 . 等物质的量浓度、等体积的下列溶液中(1)H2CO3 (2)Na2CO3 (3)NaHCO3 (4)NH4HCO3 (5)(NH4)2CO3。下列关系或者说法正确的是( )
| A.c(HCO3-)的大小关系为:(4)>(3)>(5)>(2)>(1) |
| B.c(CO32-)的大小关系为:(1)<(4)<(3)<(5)<(2) |
| C.将溶液蒸干后灼烧后只有(1)不能得到对应的固体物质 |
| D.(2)(3)(4)(5)既能与盐酸反应,又能与NaOH溶液反应 |
您最近一年使用:0次
2019-11-24更新
|
335次组卷
|
12卷引用:2016届河北省行唐启明中学高三上学期12月月考化学试卷
2016届河北省行唐启明中学高三上学期12月月考化学试卷2017届河北省定州中学高三上学期第二次月考化学卷2016-2017学年河北省邢台一中高二上月考二化学卷2016-2017学年吉林省长春市第十一高中高二上学期期初考试化学试卷2016-2017学年山东省桓台二中高二上学期期中化学试卷苏教版高三单元精练检测八化学试题福建省闽侯第六中学2017-2018学年高二12月月考化学试题山东省枣庄市第八中学南校区2017-2018学年高二上学期第二次月考(12月)化学试题河南省鲁山县第一高级中学2019-2020学年高二11月月考化学试题江西省吉安市省重点中学2020-2021学年高二上学期期中联合考试化学试题江西省吉安市2020-2021学年高二上学期期中统考化学试题第3课时 溶液中粒子浓度的大小比较
名校
8 . 下列浓度关系正确的是( )
| A.0.1 mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H +) |
| B.若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L |
| C.0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+) |
| D.向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-) |
您最近一年使用:0次
2017-12-23更新
|
248次组卷
|
5卷引用:河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题
河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题江西省新余市第四中学、上高二中2018届高三第一次联考化学试题湖北省孝感高级中学2017-2018学年高二上学期期末考试化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题11 电解质溶液类选择题解题方法和策略四川省宜宾市叙州区第一中学2019届高三下学期4月月考理科综合化学试题
名校
9 . 下列物质的水溶液经加热浓缩、蒸干灼烧仍能得到原物质的是
| A.Ca(HCO3)2 | B.Na2SO3 | C.AlCl3 | D.NaAlO2 |
您最近一年使用:0次
2017-11-07更新
|
272次组卷
|
2卷引用:河北省定州中学2018届高三下学期开学考试化学试题
名校
解题方法
10 . (1)已知下表数据:
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______ (填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______ ,c(HCN)+c(CN-)_____ (填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______ (填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________ 。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______ (填序号)。
①混合溶液的pH=7 ②c(SO42-)= c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是
①混合溶液的pH=7 ②c(SO42-)=
 c(A+)
c(A+)③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=

您最近一年使用:0次
2017-08-19更新
|
677次组卷
|
5卷引用:河北省邯郸市大名县第一中学2022-2023学年高三上学期第一次月考化学试题



