名校
1 . 常温下, 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是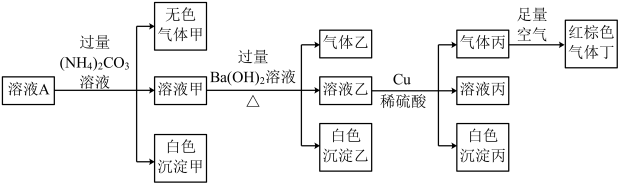
A.溶液A中一定含有 、 、 、 、 、 、 |
B.若实验消耗 14.4g,则生成气体丁的体积为3.36L 14.4g,则生成气体丁的体积为3.36L |
C.沉淀乙中一定有 ,可能有 ,可能有 |
D.溶液A中一定没有 ,但是无法确定是否含有 ,但是无法确定是否含有 |
您最近一年使用:0次
2023-02-08更新
|
241次组卷
|
17卷引用:安徽省名校2020-2021学年高二下学期5月第二次联考化学试题
安徽省名校2020-2021学年高二下学期5月第二次联考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题1江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题(已下线)黄金30题系列 高三化学 小题易丢分陕西省陕师大附中2018届高三第五次月考化学试题河南省南阳市第一中学校2018届高三第七次考试理综化学试题河北省定州中学2018届高三(承智班)下学期开学考试化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2西藏自治区拉萨中学2018届高三第六次月考理综化学试题湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题陕西省西安中学2021-2022学年高三上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖南省常德市第一中学 2023届高三7月摸底考试化学试题(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)学科特色6 离子推断湖南省永州市祁阳县第四中学2023-2024学年高三上学期第三次段考化学试题
名校
解题方法
2 . 常温下,用 盐酸滴定25.00mL
盐酸滴定25.00mL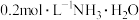 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是

 盐酸滴定25.00mL
盐酸滴定25.00mL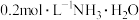 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
A.曲线①代表 ,曲线②代表 ,曲线②代表 |
| B.当溶液显中性时,滴入盐酸的体积小于25mL |
C. 的电离常数的数量级为 的电离常数的数量级为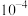 |
D.a点溶液中存在 |
您最近一年使用:0次
2022-11-05更新
|
1120次组卷
|
5卷引用:安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷
(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷河南省南阳市2022-2023学年高三上学期期中质量评估化学试题(已下线)模拟卷03-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)河南省南阳市2022-2023学年高三上学期11月期中考试化学试题宁夏六盘山高级中学2023-2024学年高三一模考试化学试题
3 . 25℃时,向0.10 元弱酸
元弱酸 溶液逐滴滴入NaOH溶液,溶液中的
溶液逐滴滴入NaOH溶液,溶液中的 、
、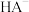 、
、 的物质的量分数
的物质的量分数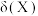 随pH的变化如图所示[已知
随pH的变化如图所示[已知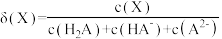 ];
];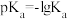 。下列叙述错误的是
。下列叙述错误的是

 元弱酸
元弱酸 溶液逐滴滴入NaOH溶液,溶液中的
溶液逐滴滴入NaOH溶液,溶液中的 、
、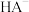 、
、 的物质的量分数
的物质的量分数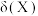 随pH的变化如图所示[已知
随pH的变化如图所示[已知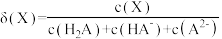 ];
];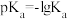 。下列叙述错误的是
。下列叙述错误的是
A. , , |
B. 时, 时,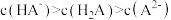 |
C.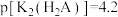 |
D. 时, 时,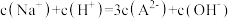 |
您最近一年使用:0次
2021-11-08更新
|
746次组卷
|
5卷引用:安徽省太和县第八中学2021-2022学年高二上学期期中考试化学试题
4 . 设NA为阿伏加 德罗常数的值,下列说法正确的是
| A.用惰性电极电解MgSO4溶液,加入0.1molH2O能使溶液复原,则电路中转移的电子数为0.4NA |
| B.100g质量分数为46%的乙醇溶液中含有氢原子的数目为6NA |
| C.100mL 12mol•L-1 HNO3溶液与过量Cu反应,转移的电子数为0.6NA |
| D.1L 0.1mol•L-1 Na2CO3溶液中,阴离子总数大于0.1NA |
您最近一年使用:0次
名校
解题方法
5 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,一些水管的活塞会“自动”熔化,喷出水来。由一种铋矿(主要成分为Bi2S3,含强氧化性杂质PbO2等)制备金属铋的简单工艺如图:

已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括___ 、___ 。
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是___ 。
(3)检验母液中主要金属阳离子的方法是___ 。
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为___ g/L,达到滴定终点的现象是__ 。
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为__ ;电解一段时间后,电解液会有损失,并会出现大量杂质,加入___ (填化学式)可以除去该杂质,并使电解液H2SiF6再生。

已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是
(3)检验母液中主要金属阳离子的方法是
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为
您最近一年使用:0次
名校
6 . 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka________ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是______________________ (填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________ (填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___ mol·L-1(填精确数值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。

稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”,下同)醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____ HX。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。

稀释后,HX溶液中水电离出来的c(H+)
您最近一年使用:0次
2018-10-26更新
|
1453次组卷
|
3卷引用:安徽省阜阳三中2018-2019学年高二第一学期第一次调研考试化学试题
安徽省阜阳三中2018-2019学年高二第一学期第一次调研考试化学试题专题2.3 水溶液中的离子平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)第23讲 弱电解质的电离平衡(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
7 . 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g) 2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1
②NO2(g)+CO(g) NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=__________ kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________ 用K1、K2、K3表示)
(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示
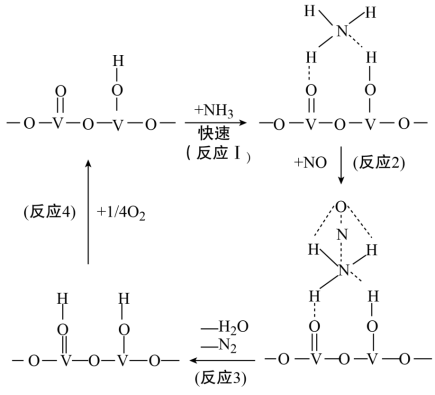
①写出总反应化学方程式__________________________________ 。
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是____________ 反应(填“吸热”或“放热”)。
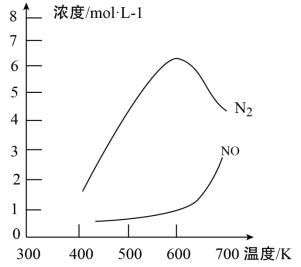
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为____________ ;当温度达到700K时,发生副反应的化学方程式________________________ 。
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:

试解释在温度较高时,(NH4)2SO3氧化速率下降的原因是________________________ ;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH4+)前者____________ (填“大”小”)
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)
 2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1②NO2(g)+CO(g)
 NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1则反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示

①写出总反应化学方程式
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为

(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:

试解释在温度较高时,(NH4)2SO3氧化速率下降的原因是
您最近一年使用:0次
2018-06-06更新
|
402次组卷
|
2卷引用:安徽省宿州市2018届高三第三次教学质量检测理综化学试题
8 . 羟氨(NH2OH )为一元弱碱(25℃时,电高常数Kb=9.0×10-9),其电离方程式为NH2OH+H2O  NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是

 NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是
| A.V1<10 |
| B.A点对应溶液的pH=9.5 |
| C.A 、B、C 、D四点对应的溶液中NH2OH电离常数相等 |
| D.D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH ) |
您最近一年使用:0次
名校
9 . 在蒸发皿中加热蒸干下列物质的溶液并灼烧,可得原有物质的固体是
| A.氯化铝 | B.碳酸氢钠 |
| C.硫酸铁 | D.亚硫酸钠 |
您最近一年使用:0次



