名校
解题方法
1 . 下列图像及对图像的分析结果均正确的是


A.图一中A点应当填写 |
B.图二表示不同温度下发生反应  。实验Ⅱ相比实验Ⅰ、Ⅲ,除温度不同外还可能使用了催化剂 。实验Ⅱ相比实验Ⅰ、Ⅲ,除温度不同外还可能使用了催化剂 |
C.图三为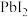 固体放入水中后,t时刻改变的条件是向溶液中加入KI固体, 固体放入水中后,t时刻改变的条件是向溶液中加入KI固体,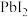 的 的 增大 增大 |
D.图四纵坐标为各粒子分布系数,将均为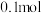 的 的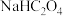 和 和 固体混合物溶于1L水中,所得溶液pH为4.2 固体混合物溶于1L水中,所得溶液pH为4.2 |
您最近一年使用:0次
2023-12-12更新
|
413次组卷
|
2卷引用:山西省朔州市怀仁市2023-2024学年高二上学期1月期末化学试题
11-12高二下·浙江温州·期末
名校
解题方法
2 . 为了除去氯化镁酸性溶液中的铁离子,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A.一水合氨 | B.烧碱 | C.碳酸镁 | D.碳酸钠 |
您最近一年使用:0次
2020-07-03更新
|
255次组卷
|
13卷引用:山西省稷山中学2021-2022学年高二上学期第二次月考化学试题
山西省稷山中学2021-2022学年高二上学期第二次月考化学试题(已下线)2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷(已下线)2012-2013学年江苏省宿迁市泗洪县洪翔中学高二下学期期中考化学卷(已下线)2012-2013学年四川省雅安市高二下学期期末检测化学试卷(已下线)2014届福建省福州市高三上学期期末质量检测化学试卷2015届福建省三明市一中高三上学期第二次月考化学试卷黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期10月考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(能力卷)试题2020届高三化学二轮冲刺新题专练——过滤(抽滤)、蒸发、结晶等除杂分离法北京市中国人民大学附属中学 2019-2020 学年度高二下学期期末练习化学试题(已下线)3.3.2 影响盐类水解的因素(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题
解题方法
3 . 聚合硫酸铁简称聚铁[Fe2(OH)6-2n(SO4)n]m广泛用于饮用水等的净化。某化工厂利用硫酸铜废液制备聚铁,其流程如下:
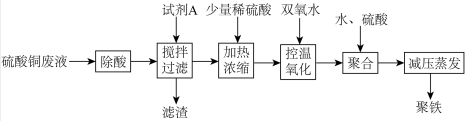
回答下列问题:
(1)试剂A为__________ 。
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了_______ ,“聚合”时加硫酸是为了控制溶液的pH在一定范围内,若pH偏大,则_________ 。
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是________ 。
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从_____ (填字母)口通入冷水,再打开旋转主机;实验结束时应先关闭旋转主机,再_______ ,打开阀门a通大气后,最后取下______ (填仪器名称),从中获得聚铁。本实验采取减压蒸发的理由是___________ 。

(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 mol•L-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=_______ 。
②若m=4,写出“聚合”过程的化学方程式:______ 。

回答下列问题:
(1)试剂A为
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从

(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 mol•L-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=
②若m=4,写出“聚合”过程的化学方程式:
您最近一年使用:0次
名校
4 . 碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
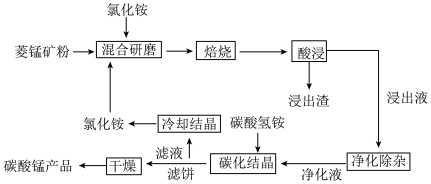
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________

(4)净化除杂流程如下
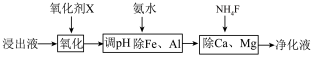
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A.(NH4)2S2O8 B.MnO2 C.KMnO4
②调节pH时,pH可取的范围为_________________
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________

已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“混合研磨”的作用为
(2)“焙烧”时发生的主要反应的化学方程式为
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是

(4)净化除杂流程如下

①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择
A.(NH4)2S2O8 B.MnO2 C.KMnO4
②调节pH时,pH可取的范围为
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是
您最近一年使用:0次
2020-05-08更新
|
242次组卷
|
2卷引用:山西省忻州市静乐县第一中学2019-2020学年高二下学期第一次月考化学试题
名校
5 . 下列有关说法正确的是
| A.由MgCl2溶液制备无水MgCl2,将MgCl2溶液加热蒸干 |
| B.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+ |
| C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D.AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
您最近一年使用:0次
2019-01-08更新
|
204次组卷
|
2卷引用:【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题
6 . 25℃时,下列各组离子在指定溶液中一定大量共存的是( )
| A.pH=1的溶液中:K+、Fe3+、NO3-、Cl- |
| B.0.1mol·L-1NaHCO3溶液:Na+、Ba2+、NO3-、AlO2- |
| C.0.1mol·L-1的AlCl3溶液中:H+、NH4+、SO42-、S2- |
| D.由水电离出的c(H+)=10-13溶液中:Na+、K+、Cl-、OH- |
您最近一年使用:0次
名校
解题方法
7 . 碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____ 。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____ (填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
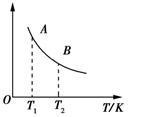
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________ 。
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____ (填字母)。
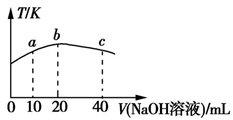
a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g)
 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;CH4(g) + 4NO(g)
 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)
 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
您最近一年使用:0次
名校
解题方法
8 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
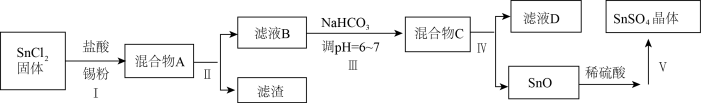
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
2017-05-15更新
|
706次组卷
|
2卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题



