绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g) 2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1
②NO2(g)+CO(g) NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=__________ kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________ 用K1、K2、K3表示)
(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示
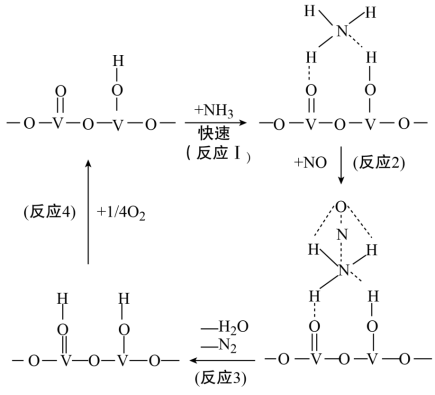
①写出总反应化学方程式__________________________________ 。
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是____________ 反应(填“吸热”或“放热”)。
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为____________ ;当温度达到700K时,发生副反应的化学方程式________________________ 。
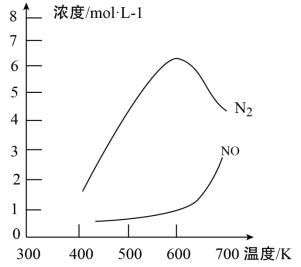
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:

试解释在温度较高时,(NH4)2SO3氧化速率下降的原因是________________________ ;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH4+)前者____________ (填“大”小”)
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)
 2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1②NO2(g)+CO(g)
 NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1则反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示

①写出总反应化学方程式
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为

(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:

试解释在温度较高时,(NH4)2SO3氧化速率下降的原因是
更新时间:2018-06-06 12:19:30
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应N2+O2 2NO,这是导致汽车尾气中含有NO的原因之一。一定条件下,将2 mol NO与1 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
2NO,这是导致汽车尾气中含有NO的原因之一。一定条件下,将2 mol NO与1 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)  2NO2(g),下列各项能说明反应达到平衡状态的是
2NO2(g),下列各项能说明反应达到平衡状态的是______ (填字母代号)。
a.体系的压强保持不变
b.混合气体的密度保持不变
c.混合气体的颜色保持不变
d.NO和O2的物质的量之比保持不变
e.每消耗1 mol O2的同时生成2 mol NO2
(2)已知:①N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ/mol;②C和CO的燃烧热分别为393.5 kJ/mol和283.0 kJ/mol。则2NO(g)+2CO(g)===N2 (g)+2CO2 (g) ΔH=________ kJ/mol。
现将0.20 mol NO和0.10 mol CO充入一个容积为2 L的密闭容器中发生上述反应,反应过程中部分物质的物质的量变化如图所示。
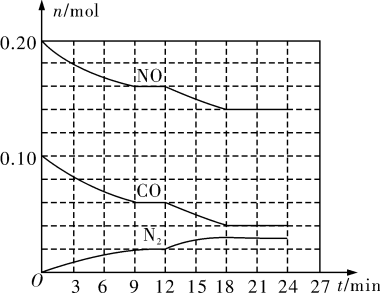
N2在0~9 min内的平均反应速率v(N2)=_____ mol/(L·min)(保留两位有效数字);第12 min时改变的反应条件可能为_______ (填字母代号)。
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=9的Na2SO3溶液,吸收过程中NaOH溶液中水的电离平衡______ (填“向左”“向右”或“不”)移动。试计算所得溶液中 =
=______ (已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(1)汽车内燃机工作时会引起N2和O2的反应N2+O2
 2NO,这是导致汽车尾气中含有NO的原因之一。一定条件下,将2 mol NO与1 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
2NO,这是导致汽车尾气中含有NO的原因之一。一定条件下,将2 mol NO与1 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)  2NO2(g),下列各项能说明反应达到平衡状态的是
2NO2(g),下列各项能说明反应达到平衡状态的是a.体系的压强保持不变
b.混合气体的密度保持不变
c.混合气体的颜色保持不变
d.NO和O2的物质的量之比保持不变
e.每消耗1 mol O2的同时生成2 mol NO2
(2)已知:①N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ/mol;②C和CO的燃烧热分别为393.5 kJ/mol和283.0 kJ/mol。则2NO(g)+2CO(g)===N2 (g)+2CO2 (g) ΔH=
现将0.20 mol NO和0.10 mol CO充入一个容积为2 L的密闭容器中发生上述反应,反应过程中部分物质的物质的量变化如图所示。

N2在0~9 min内的平均反应速率v(N2)=
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=9的Na2SO3溶液,吸收过程中NaOH溶液中水的电离平衡
 =
=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】甲烷化技术是煤制天然气最核心、最关键的技术。
甲烷化主要反应:Ⅰ、
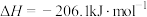
主要积炭反应:Ⅱ、
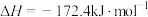
Ⅲ、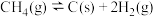
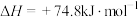
回答下列问题:
(1)计算副反应 的
的
___________  ;若反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为a、b、c,则副反应
;若反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为a、b、c,则副反应 的平衡常数
的平衡常数
___________ (用含a、b、c的代数式表示)。
(2)将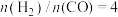 的混合气体充入某密闭容器中,在T
的混合气体充入某密闭容器中,在T 和x
和x 下反应Ⅰ达到平衡时(假设其他反应不发生),
下反应Ⅰ达到平衡时(假设其他反应不发生), 的分压与
的分压与 的分压相等,此时
的分压相等,此时 的平衡转化率为
的平衡转化率为___________ ,压强平衡常数
___________ 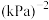 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)控制起始时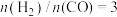 ,测得平衡时
,测得平衡时 在不同压强下的平衡转化率和积炭率分别如图1、图2所示:
在不同压强下的平衡转化率和积炭率分别如图1、图2所示:
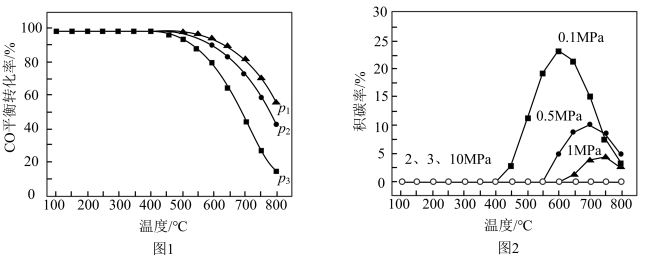
①图1中压强由大到小的顺序为___________ 。
②图2中,在相同的较高温度下,压强越小,积炭率越高的主要原因是___________ 。
③图2中,在较高温度下,同一压强时,积炭率先增大后减小,其中减小的可能原因是___________ 。
甲烷化主要反应:Ⅰ、

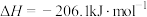
主要积炭反应:Ⅱ、

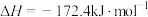
Ⅲ、
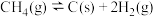
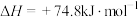
回答下列问题:
(1)计算副反应
 的
的
 ;若反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为a、b、c,则副反应
;若反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为a、b、c,则副反应 的平衡常数
的平衡常数
(2)将
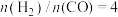 的混合气体充入某密闭容器中,在T
的混合气体充入某密闭容器中,在T 和x
和x 下反应Ⅰ达到平衡时(假设其他反应不发生),
下反应Ⅰ达到平衡时(假设其他反应不发生), 的分压与
的分压与 的分压相等,此时
的分压相等,此时 的平衡转化率为
的平衡转化率为
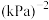 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。(3)控制起始时
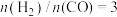 ,测得平衡时
,测得平衡时 在不同压强下的平衡转化率和积炭率分别如图1、图2所示:
在不同压强下的平衡转化率和积炭率分别如图1、图2所示:
①图1中压强由大到小的顺序为
②图2中,在相同的较高温度下,压强越小,积炭率越高的主要原因是
③图2中,在较高温度下,同一压强时,积炭率先增大后减小,其中减小的可能原因是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】我国2030年要实现碳达峰,CO2加氢可缓解CO2带来的环境压力,同时带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH=-165.0kJ/mol
CH4(g)+2H2O(g) ΔH=-165.0kJ/mol
反应Ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.18kJ/mol
CO(g)+H2O(g) ΔH=+41.18kJ/mol
回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为_______
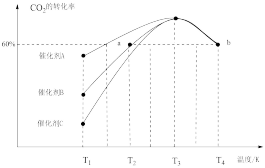
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最高的反应所用的催化剂是催化剂_______ (填“A”、“B”或“C”)。
(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按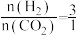 ,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
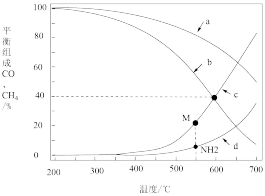
①0.1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 、_______
②当CH4和CO平衡组成均为40%时,该温度下反应Ⅲ的平衡常数Kp为_______
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
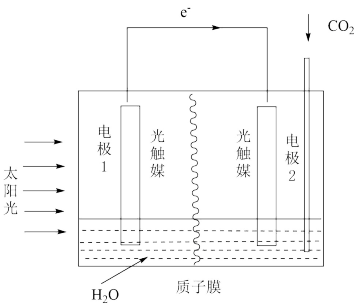
①电极2的电极反应式为_______
②在标准状况下,当电极2室有5.6LCO2反应,则膜两侧电解液质量变化差(Δm右-Δm左)为_______ g
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-60.0kJ/mol反应Ⅱ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH=-165.0kJ/mol
CH4(g)+2H2O(g) ΔH=-165.0kJ/mol反应Ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.18kJ/mol
CO(g)+H2O(g) ΔH=+41.18kJ/mol回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最高的反应所用的催化剂是催化剂

(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按
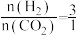 ,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
①0.1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
②当CH4和CO平衡组成均为40%时,该温度下反应Ⅲ的平衡常数Kp为
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式为
②在标准状况下,当电极2室有5.6LCO2反应,则膜两侧电解液质量变化差(Δm右-Δm左)为
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】由于雾霾严重,长沙市19年12月15、16日在部分路段施行了限行。已知汽车尾气排放出的 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)汽车尾气中的 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应:
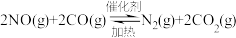

已知:① 燃烧热的
燃烧热的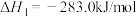
②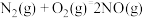
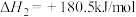 ,则
,则
__________ 。
(2)某研究小组对反应
 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率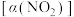 ,部分实验结果如图1所示。
,部分实验结果如图1所示。

①如果将图中 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是__________ 。
②图中 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为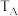 和
和 ,通过判断:
,通过判断: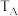
__________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)工业废气也是产生雾霾的重要原因,某厂采用湿法 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
① 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:____________________ 。
②过二硫酸钾可通过电解 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
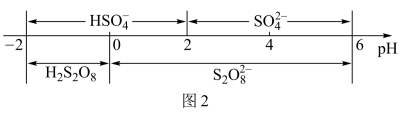
已知在阳极放电的离子主要是 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为__________ ;阳极的电极反应式为______________________________ 。
 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。(1)汽车尾气中的
 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应: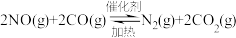

已知:①
 燃烧热的
燃烧热的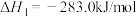
②
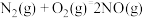
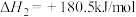 ,则
,则
(2)某研究小组对反应

 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率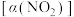 ,部分实验结果如图1所示。
,部分实验结果如图1所示。
①如果将图中
 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是②图中
 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为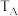 和
和 ,通过判断:
,通过判断: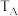
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)工业废气也是产生雾霾的重要原因,某厂采用湿法
 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。①
 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:②过二硫酸钾可通过电解
 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
已知在阳极放电的离子主要是
 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g) N2O4(g)△H<0。
N2O4(g)△H<0。

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)______________ v(B) (填“<”、“>”或“=”);若打开活塞K2,气球B将______________ (填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将_______________ 。若通入等量的Ne气,则达到平衡时,A中NO2的转化率将______________ ,B中NO2的转化率将______________ 。
(3)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率______________ 。
 N2O4(g)△H<0。
N2O4(g)△H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将
(3)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】近日,我国建成首个“西氢东送”输氢管道示范工程。目前,市面上绝大多数氢气是灰氢,约占当今全球氢气产量的95%。灰氢主要是通过煤炭、天然气等制备合成气,再分离出氢气,也可以利用合成气(CO,H2)制备C1、C2等化工产品。
已知:“灰氢”制备主要原理如下:
反应1: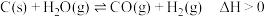
反应2:
(1)已知:①
②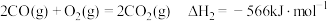
③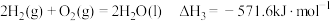
④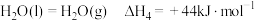
反应2中
_________  。
。
(2)乙醇是一种清洁能源和化工原料。工业上利用合成气合成乙醇: 。
。
①一定温度下,在某恒容密闭容器中充入 和2molH2(g)仅发生上述反应。下列说法正确的是
和2molH2(g)仅发生上述反应。下列说法正确的是________ (填字母)。
A.当混合气体的密度不再随时间变化时达到平衡
B.当混合气体的平均摩尔质量不再随时间变化时达到平衡
C.平衡时 的体积分数小于25%
的体积分数小于25%
D.其他条件不变,增大投料比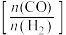 ,CO的平衡转化率增大
,CO的平衡转化率增大
②对于该反应,不同温度对CO的平衡转化率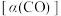 及催化剂的效率影响如图1所示。
及催化剂的效率影响如图1所示。

M点的平衡常数________ (填“大于”“小于”或“等于”)N点的平衡常数;其他条件不变,不加催化剂,则250℃时CO的平衡转化率________ (填“可能”或“不可能”)移至M1点。
(3)T℃时,在VL恒容密闭容器中充入6molCO(g)和8molH2(g),只发生反应: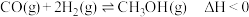 。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
①T℃时,该反应平衡时的总压强为________ ,该反应的压强平衡常数
________  (结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
(结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间的变化关系分别如图2中状态Ⅱ和Ⅲ所示,则状态________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)的平衡常数最小。
已知:“灰氢”制备主要原理如下:
反应1:
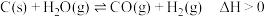
反应2:

(1)已知:①

②
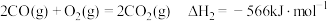
③
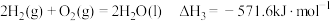
④
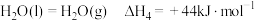
反应2中

 。
。(2)乙醇是一种清洁能源和化工原料。工业上利用合成气合成乙醇:
 。
。①一定温度下,在某恒容密闭容器中充入
 和2molH2(g)仅发生上述反应。下列说法正确的是
和2molH2(g)仅发生上述反应。下列说法正确的是A.当混合气体的密度不再随时间变化时达到平衡
B.当混合气体的平均摩尔质量不再随时间变化时达到平衡
C.平衡时
 的体积分数小于25%
的体积分数小于25%D.其他条件不变,增大投料比
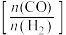 ,CO的平衡转化率增大
,CO的平衡转化率增大②对于该反应,不同温度对CO的平衡转化率
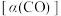 及催化剂的效率影响如图1所示。
及催化剂的效率影响如图1所示。
M点的平衡常数
(3)T℃时,在VL恒容密闭容器中充入6molCO(g)和8molH2(g),只发生反应:
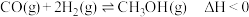 。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。①T℃时,该反应平衡时的总压强为

 (结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
(结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间的变化关系分别如图2中状态Ⅱ和Ⅲ所示,则状态
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________ ;该反应能量转化的主要方式为_________ 。
②反应4的热化学方程式为2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l) SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g) 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________ 。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g) 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________ (填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________ 。
③下列有关图象一定正确的是__________ (填字母)。
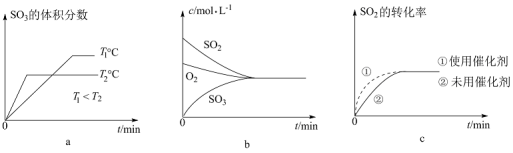
(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________ 1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________ (填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变

(1)①反应2的化学方程式为
②反应4的热化学方程式为2H2SO4(l)
 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol已知:a. H2SO4(l)
 SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=Xb.2SO3(g)
 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol则X=
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g)
 2SO3(g) △H<0。
2SO3(g) △H<0。①下列有关该反应速率的叙述正确的是
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=
③下列有关图象一定正确的是

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g)
 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:①a+b
②下列叙述能说明甲容器中反应达平衡状态的是
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。
(1)已知:CO2(g)+2H2(g)⇌C(s)+2H2O(g) △H=−90.0kJ·mol−1
H2O(1)═H2O(g) △H=+44.0kJ·mol−1
C(s)的燃烧热△H=−394.0kJ·mol−1
则表示H2燃烧热的热化学方程式为___________________________
(2)在0.1MPa、Ru/TiO2催化下,将H2和CO2按投料比n(H2):n(CO2)=4:1置于恒压密闭容器中发生反应:
反应I CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) △H1
反应II CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2
测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示。
(选择性:转化的CO2中生成CH4或CO的百分比)
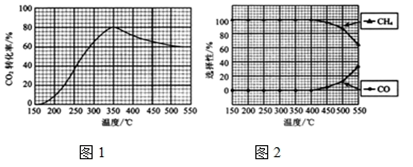
①反应I的△H1______ (填“>”、“<“或“=”)0;理由是__________________________
②温度过高或过低均不利于反应I的进行,原因是______________________________
③350℃时,反应I的平衡常数Kp=______________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④为减少CO在产物中的比率,可采取的措施有__________________ (列举一条)
(1)已知:CO2(g)+2H2(g)⇌C(s)+2H2O(g) △H=−90.0kJ·mol−1
H2O(1)═H2O(g) △H=+44.0kJ·mol−1
C(s)的燃烧热△H=−394.0kJ·mol−1
则表示H2燃烧热的热化学方程式为
(2)在0.1MPa、Ru/TiO2催化下,将H2和CO2按投料比n(H2):n(CO2)=4:1置于恒压密闭容器中发生反应:
反应I CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) △H1
反应II CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2
测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示。
(选择性:转化的CO2中生成CH4或CO的百分比)

①反应I的△H1
②温度过高或过低均不利于反应I的进行,原因是
③350℃时,反应I的平衡常数Kp=
④为减少CO在产物中的比率,可采取的措施有
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】选择性催化还原法 是常用的氮氧化物
是常用的氮氧化物 的净化方法,原理是用
的净化方法,原理是用 在特定催化剂作用下将
在特定催化剂作用下将 ,还原为
,还原为 .
.
反应Ⅰ:
反应Ⅱ:
(1)反应Ⅱ_______ 反应Ⅰ(填“有利于”或“不利于”)中 的净化;一定温度和压强下,为了提高
的净化;一定温度和压强下,为了提高 的净化速率,可采取的最合理的措施是
的净化速率,可采取的最合理的措施是__________ .
(2) 是
是 催化剂的活性组分.在反应器中以一定流速通过烟气
催化剂的活性组分.在反应器中以一定流速通过烟气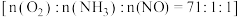 ,在不同温度下进行该催化还原反应,
,在不同温度下进行该催化还原反应, 的质量分数对单位时间内
的质量分数对单位时间内 去除率的影响如图所示.
去除率的影响如图所示.
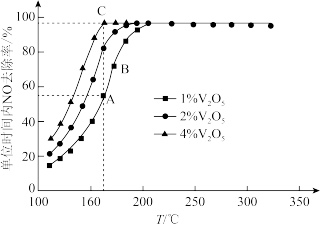
①下列说法中正确的是_________ (填标号).
A.该催化剂能加快反应速率,但不能改变反应的焓变
B.状态A时保持其他条件不变减小压强,能增大单位时间 的去除率
的去除率
C.状态B时选择合适催化剂,可以提高相同时间内 的去除率
的去除率
D. 的质量分数越高,催化剂的活性越好
的质量分数越高,催化剂的活性越好
E.该催化剂具有选择性,能降低特定反应的活化能
②从起始至对应A、B、C三点的平均反应速率由大到小的顺序为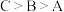 ,原因是
,原因是_________________ .
③若烟气中 含量一定,在催化剂适宜温度范围内,当
含量一定,在催化剂适宜温度范围内,当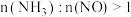 时,随着该比值的增大,
时,随着该比值的增大, 去除率无明显变化,可能的原因是
去除率无明显变化,可能的原因是______________________ .
(3)一定温度下,向 密闭刚性容器(含催化剂)中投入
密闭刚性容器(含催化剂)中投入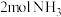 和
和 ,发生反应
,发生反应 .达到平衡状态时,
.达到平衡状态时, 的转化率为60%,此时再加入
的转化率为60%,此时再加入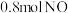 和
和 ,则反应速率
,则反应速率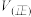
______ 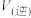 (填“大于”、“小于”、“等于”).
(填“大于”、“小于”、“等于”).
 是常用的氮氧化物
是常用的氮氧化物 的净化方法,原理是用
的净化方法,原理是用 在特定催化剂作用下将
在特定催化剂作用下将 ,还原为
,还原为 .
.反应Ⅰ:

反应Ⅱ:
(1)反应Ⅱ
 的净化;一定温度和压强下,为了提高
的净化;一定温度和压强下,为了提高 的净化速率,可采取的最合理的措施是
的净化速率,可采取的最合理的措施是(2)
 是
是 催化剂的活性组分.在反应器中以一定流速通过烟气
催化剂的活性组分.在反应器中以一定流速通过烟气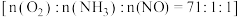 ,在不同温度下进行该催化还原反应,
,在不同温度下进行该催化还原反应, 的质量分数对单位时间内
的质量分数对单位时间内 去除率的影响如图所示.
去除率的影响如图所示.
①下列说法中正确的是
A.该催化剂能加快反应速率,但不能改变反应的焓变
B.状态A时保持其他条件不变减小压强,能增大单位时间
 的去除率
的去除率C.状态B时选择合适催化剂,可以提高相同时间内
 的去除率
的去除率D.
 的质量分数越高,催化剂的活性越好
的质量分数越高,催化剂的活性越好E.该催化剂具有选择性,能降低特定反应的活化能
②从起始至对应A、B、C三点的平均反应速率由大到小的顺序为
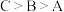 ,原因是
,原因是③若烟气中
 含量一定,在催化剂适宜温度范围内,当
含量一定,在催化剂适宜温度范围内,当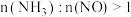 时,随着该比值的增大,
时,随着该比值的增大, 去除率无明显变化,可能的原因是
去除率无明显变化,可能的原因是(3)一定温度下,向
 密闭刚性容器(含催化剂)中投入
密闭刚性容器(含催化剂)中投入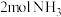 和
和 ,发生反应
,发生反应 .达到平衡状态时,
.达到平衡状态时, 的转化率为60%,此时再加入
的转化率为60%,此时再加入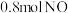 和
和 ,则反应速率
,则反应速率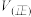
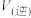 (填“大于”、“小于”、“等于”).
(填“大于”、“小于”、“等于”).
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】镍常作催化剂。以镍废料(主要成分为Ni,含 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图所示:
)为原料制备纯镍的流程如图所示:
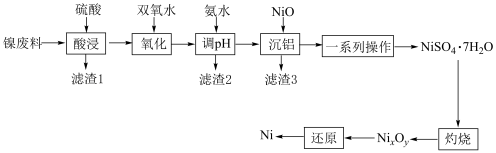
回答下列问题:
(1)“酸浸”得到滤渣1的主要成分是 和
和__________ (填化学式)。“酸浸”中镍浸出率与硫酸浓度的关系如图所示。
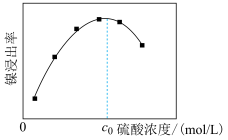
硫酸浓度大于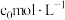 时,镍浸出率降低的可能原因是
时,镍浸出率降低的可能原因是_____________________ (答一条)。
(2)“氧化”中双氧水的作用是______________________ (用离子方程式表示)。
(3)“沉铝”中NiO的作用是________________________________________ 。
(4) 在隔绝空气条件下的热失重曲线如图所示。
在隔绝空气条件下的热失重曲线如图所示。
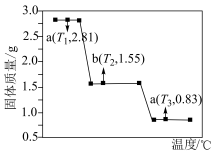
a→b反应的化学方程式是________________________ ,c点对应的氧化物为____________ (填化学式)。
(5)Ni和Nb可组成一种合金材料,其晶胞结构如图所示。
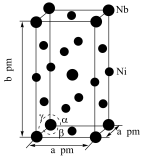
设 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值,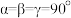 ,该晶胞中Ni、Nb的个数之比为
,该晶胞中Ni、Nb的个数之比为_____________ 。该晶体的密度为_________  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图所示:
)为原料制备纯镍的流程如图所示:
回答下列问题:
(1)“酸浸”得到滤渣1的主要成分是
 和
和
硫酸浓度大于
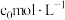 时,镍浸出率降低的可能原因是
时,镍浸出率降低的可能原因是(2)“氧化”中双氧水的作用是
(3)“沉铝”中NiO的作用是
(4)
 在隔绝空气条件下的热失重曲线如图所示。
在隔绝空气条件下的热失重曲线如图所示。
a→b反应的化学方程式是
(5)Ni和Nb可组成一种合金材料,其晶胞结构如图所示。

设
 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值,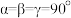 ,该晶胞中Ni、Nb的个数之比为
,该晶胞中Ni、Nb的个数之比为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
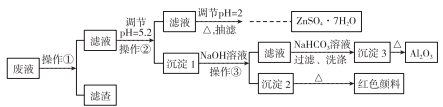
【推荐2】用Zn(主要含有Fe、Al、Pb杂质)和硫酸来制取H2,利用制氢废液制备硫酸锌晶体(ZnSO4·7H2O)、Al2O3和Fe2O3,流程如下:
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是______________ ,调节pH=2,可加入_________ (填化学式)。
(2)写出生成沉淀3的化学方程式:______________________ 。
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是_____________ 。
(4)某同学用如图所示的装置抽滤。
①有关抽滤的说法正确的是__________ 。
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是___________________________ 。
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是________ 。
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中自然干燥
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是
(2)写出生成沉淀3的化学方程式:
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是
(4)某同学用如图所示的装置抽滤。
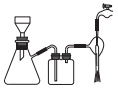
①有关抽滤的说法正确的是
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中自然干燥
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
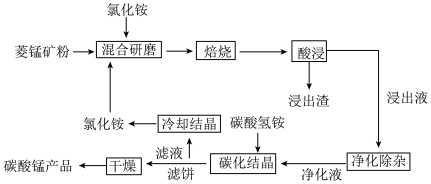
【推荐3】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________

(4)净化除杂流程如下
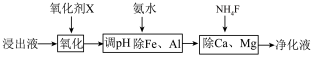
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A.(NH4)2S2O8 B.MnO2 C.KMnO4
②调节pH时,pH可取的范围为_________________
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________

已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“混合研磨”的作用为
(2)“焙烧”时发生的主要反应的化学方程式为
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是

(4)净化除杂流程如下

①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择
A.(NH4)2S2O8 B.MnO2 C.KMnO4
②调节pH时,pH可取的范围为
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是
您最近半年使用:0次



