1 . 常温下,几种物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入___________ 调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=___________ 。
过滤后,将所得滤液经浓缩、过滤、洗涤、低温干燥操作,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是___________ 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。向其中加入淀粉溶液后,用0.1000 mol∙L−1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①CuCl2溶液与KI反应的离子方程式为___________ 。
②选用淀粉溶液作指示剂,滴定终点的现象是___________ 。
③该试样中CuCl2·2H2O的质量百分数为___________ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10−20 | 2.6×10−39 | 1.7×10−7 | 1.3×10−12 |
过滤后,将所得滤液经浓缩、过滤、洗涤、低温干燥操作,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。向其中加入淀粉溶液后,用0.1000 mol∙L−1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。①CuCl2溶液与KI反应的离子方程式为
②选用淀粉溶液作指示剂,滴定终点的现象是
③该试样中CuCl2·2H2O的质量百分数为
您最近一年使用:0次
2 . 铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为___________________ 。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________ 。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________________ (用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______________________________ 。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________ 。
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是
(3)硫酸铁可作絮凝剂,常用于净水,其原理是
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是
 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是
您最近一年使用:0次
解题方法
3 . 铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝元素在周期表中位置___________ ,铝离子的结构示意图为____________ 。
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是________ 。制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为____________ 。
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________ 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是__________ (填字母序号)。
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为________ (填化学式)。
(1)铝元素在周期表中位置
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对。 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错。 |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错。 |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对。 |
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为
您最近一年使用:0次
名校
4 . I.25℃时,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离的c(OH-)分别是:NaOH溶液中___________ ;Na2CO3溶液中___________ 。
(2)各取10mL上述两种溶液,分别加水稀释到100mL,pH变化较大的是___________ (填化学式)溶液。
(3)为探究纯碱溶液呈碱性是由CO 引起的,请你设计一个简单的实验方案
引起的,请你设计一个简单的实验方案___________ 。
II.现有25℃时0.1mol/L的氨水溶液。
(4)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:___________ ;所得溶液的pH___________ (填“<”、“>”或“=”)7,用离子方程式表示其原因:___________ 。
(5)若向该氨水中加入稀硫酸至溶液的pH=7,此时c(NH )=a mol/L,则c(SO
)=a mol/L,则c(SO )=
)=___________ mol/L。
(6)现有浓度均为0.01mol/L的氢氧化钠和氯化铵溶液,按体积比1:2混合后的溶液(pH>7)中各离子的浓度由大到小的顺序是___________ 。
III.盐类水解在实验室和生产生活中有广泛的应用。
(7)AgNO3的水溶液呈___________ (填“酸”、“中”、“碱”)性,原因是___________ (用离子方程式表示);实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需浓度,目的是___________
(8)FeCl3净水的原理是(用离子方程式表示)___________ ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___________ (写化学式)。
(9)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为___________ 。
(10)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则KHC2O4溶液中c(C2O )
)___________ c(H2C2O4)(填“>”、“<”或“=”)
(1)两溶液中,由水电离的c(OH-)分别是:NaOH溶液中
(2)各取10mL上述两种溶液,分别加水稀释到100mL,pH变化较大的是
(3)为探究纯碱溶液呈碱性是由CO
 引起的,请你设计一个简单的实验方案
引起的,请你设计一个简单的实验方案II.现有25℃时0.1mol/L的氨水溶液。
(4)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:
(5)若向该氨水中加入稀硫酸至溶液的pH=7,此时c(NH
 )=a mol/L,则c(SO
)=a mol/L,则c(SO )=
)=(6)现有浓度均为0.01mol/L的氢氧化钠和氯化铵溶液,按体积比1:2混合后的溶液(pH>7)中各离子的浓度由大到小的顺序是
III.盐类水解在实验室和生产生活中有广泛的应用。
(7)AgNO3的水溶液呈
(8)FeCl3净水的原理是(用离子方程式表示)
(9)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为
(10)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则KHC2O4溶液中c(C2O
 )
)
您最近一年使用:0次
解题方法
5 . 25℃时,有下列五种溶液:①0.1mol/L CH3COOH溶液;②pH=13 NaOH溶液;③ 0.05mol/L H2SO4;④0.1mol/L Na2CO3溶液;⑤含有足量AgCl固体的饱和AgCl溶液。请根据要求填写下列空白:
(1)溶液④呈_______ (填“酸性”、“碱性”或“中性”),其原因是 _______________ (用离子方程式表示)。
(2)在上述①至④四种溶液中,pH由大到小的顺序为____________________ ﹝填序号﹞。
(3)将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,则a:b =________ 。
(4)若溶液④和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为____ 。
(5)若在溶液⑤中分别放入:A、100mL蒸馏水中;B、100mL 0.2 mol·L-1AgNO3溶液中;C、100 mL 0.1 mol·L-1AlCl3溶液中;D、100mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,银离子浓度最小 的是______________ (填序号)。
(1)溶液④呈
(2)在上述①至④四种溶液中,pH由大到小的顺序为
(3)将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,则a:b =
(4)若溶液④和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为
(5)若在溶液⑤中分别放入:A、100mL蒸馏水中;B、100mL 0.2 mol·L-1AgNO3溶液中;C、100 mL 0.1 mol·L-1AlCl3溶液中;D、100mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,银离子浓度
您最近一年使用:0次
2019-06-06更新
|
249次组卷
|
3卷引用:江苏省吴江平望中学2018-2019学年高二下学期第二次阶段性测试化学试题
江苏省吴江平望中学2018-2019学年高二下学期第二次阶段性测试化学试题(已下线)期末综合测试卷02-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)江西省南昌市知行中学2021-2022学年高二上学期12月月考化学试题
6 . I.用相应的方程式解释:
(1)NaHSO3溶液显酸性:___________________
(2)NaHCO3溶液显碱性:____________________
(3)NH4Cl溶液显酸性:______________________
(4)明矾[KAl(SO4)2]净水:___________________
(5)FeCl3溶液蒸干得到Fe2O3固体:____________ (第一步反应)
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为_______ 、______ (填“减小”、“增大”或“不变”)。
(1)NaHSO3溶液显酸性:
(2)NaHCO3溶液显碱性:
(3)NH4Cl溶液显酸性:
(4)明矾[KAl(SO4)2]净水:
(5)FeCl3溶液蒸干得到Fe2O3固体:
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
您最近一年使用:0次
名校
7 . (1)铁元素的原子结构示意图为________ ;它在周期表中的位置是_________ 。
(2)某炼铜反应为: 上述反应中,氧化剂是
上述反应中,氧化剂是________ ;若反应中转移15 mol电子,则氧化产物的质量为___________ 。
(3)氧和硫分别形成的氢化物中比较稳定的是________ (写电子式)。
(4)与明矾相似,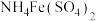 也可用作净水剂,其净水的原理是
也可用作净水剂,其净水的原理是_________ 。
(5)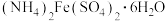 又称摩尔盐,它可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的有色阳离子:
又称摩尔盐,它可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的有色阳离子:_________________ 。
(2)某炼铜反应为:
 上述反应中,氧化剂是
上述反应中,氧化剂是(3)氧和硫分别形成的氢化物中比较稳定的是
(4)与明矾相似,
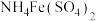 也可用作净水剂,其净水的原理是
也可用作净水剂,其净水的原理是(5)
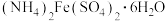 又称摩尔盐,它可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的有色阳离子:
又称摩尔盐,它可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的有色阳离子:
您最近一年使用:0次
名校
8 . 饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As( Ⅲ)亚砷酸盐和As(V)砷酸盐形式存在。
(1)砷与磷为同一主族元素,磷的原子结构示意图为___________________ 。
(2)根据元素周期律,下列说法正确的是____________________ (填字母代号)。
a.最高价氧化物对应水化物的酸性:S>P>As b. 原子半径:S>P>As c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为_________________________ 。
(4)去除水体中的砷,可先将As(Ⅲ )转化为As(V),选用NaClO可实现该转化。
已知:投料前水样pH=5.81,0.1 mol/L NaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。
研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
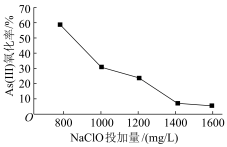
产生此结果的原因是_________________________ 。
(5)强阴离子交换柱可以吸附以阴离子形式存在的As(V),从而达到去除As的目的。
已知:一定条件下,As(V)的存在形式如下表所示:
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是_____________________ 。
(1)砷与磷为同一主族元素,磷的原子结构示意图为
(2)根据元素周期律,下列说法正确的是
a.最高价氧化物对应水化物的酸性:S>P>As b. 原子半径:S>P>As c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
(4)去除水体中的砷,可先将As(Ⅲ )转化为As(V),选用NaClO可实现该转化。
已知:投料前水样pH=5.81,0.1 mol/L NaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。
研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

产生此结果的原因是
(5)强阴离子交换柱可以吸附以阴离子形式存在的As(V),从而达到去除As的目的。
已知:一定条件下,As(V)的存在形式如下表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO4- | HAsO42- | HAsO42-、AsO43- |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是
您最近一年使用:0次



