I.25℃时,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离的c(OH-)分别是:NaOH溶液中___________ ;Na2CO3溶液中___________ 。
(2)各取10mL上述两种溶液,分别加水稀释到100mL,pH变化较大的是___________ (填化学式)溶液。
(3)为探究纯碱溶液呈碱性是由CO 引起的,请你设计一个简单的实验方案
引起的,请你设计一个简单的实验方案___________ 。
II.现有25℃时0.1mol/L的氨水溶液。
(4)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:___________ ;所得溶液的pH___________ (填“<”、“>”或“=”)7,用离子方程式表示其原因:___________ 。
(5)若向该氨水中加入稀硫酸至溶液的pH=7,此时c(NH )=a mol/L,则c(SO
)=a mol/L,则c(SO )=
)=___________ mol/L。
(6)现有浓度均为0.01mol/L的氢氧化钠和氯化铵溶液,按体积比1:2混合后的溶液(pH>7)中各离子的浓度由大到小的顺序是___________ 。
III.盐类水解在实验室和生产生活中有广泛的应用。
(7)AgNO3的水溶液呈___________ (填“酸”、“中”、“碱”)性,原因是___________ (用离子方程式表示);实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需浓度,目的是___________
(8)FeCl3净水的原理是(用离子方程式表示)___________ ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___________ (写化学式)。
(9)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为___________ 。
(10)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则KHC2O4溶液中c(C2O )
)___________ c(H2C2O4)(填“>”、“<”或“=”)
(1)两溶液中,由水电离的c(OH-)分别是:NaOH溶液中
(2)各取10mL上述两种溶液,分别加水稀释到100mL,pH变化较大的是
(3)为探究纯碱溶液呈碱性是由CO
 引起的,请你设计一个简单的实验方案
引起的,请你设计一个简单的实验方案II.现有25℃时0.1mol/L的氨水溶液。
(4)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:
(5)若向该氨水中加入稀硫酸至溶液的pH=7,此时c(NH
 )=a mol/L,则c(SO
)=a mol/L,则c(SO )=
)=(6)现有浓度均为0.01mol/L的氢氧化钠和氯化铵溶液,按体积比1:2混合后的溶液(pH>7)中各离子的浓度由大到小的顺序是
III.盐类水解在实验室和生产生活中有广泛的应用。
(7)AgNO3的水溶液呈
(8)FeCl3净水的原理是(用离子方程式表示)
(9)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为
(10)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则KHC2O4溶液中c(C2O
 )
)
21-22高二上·陕西宝鸡·阶段练习 查看更多[2]
陕西省宝鸡市长岭中学2021-2022学年高二上学期12月检测考试化学试题(已下线)3.3.3 盐类水解的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
更新时间:2022-04-07 07:33:00
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)物质的量浓度均为0.1mol/L的四种溶液;① ②NaClO③
②NaClO③ ④
④ ,溶液的pH由大到小的顺序是
,溶液的pH由大到小的顺序是___________ (填编号,下同);
(2)下列反应不能发生的是___________(填序号)。
(3)在25℃下, 的NaOH溶液中,水电离产生的
的NaOH溶液中,水电离产生的 浓度c(OH-)水=
浓度c(OH-)水=___________ ; 的
的 溶液中,水电离出来的c(OH-)水=
溶液中,水电离出来的c(OH-)水=___________ 。
(4)25℃下,将 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则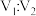 =
=___________ 。
| 化学式 |  |  | HClO |
| 电离平衡常数 | 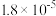 |  , ,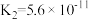 | 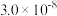 |
回答下列问题:
(1)物质的量浓度均为0.1mol/L的四种溶液;①
 ②NaClO③
②NaClO③ ④
④ ,溶液的pH由大到小的顺序是
,溶液的pH由大到小的顺序是(2)下列反应不能发生的是___________(填序号)。
A. |
B. |
C.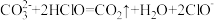 |
D.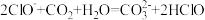 |
 的NaOH溶液中,水电离产生的
的NaOH溶液中,水电离产生的 浓度c(OH-)水=
浓度c(OH-)水= 的
的 溶液中,水电离出来的c(OH-)水=
溶液中,水电离出来的c(OH-)水=(4)25℃下,将
 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则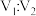 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知部分弱酸的电离平衡常数如下表,根据表中数据回答下列问题。
(1)体积相同、pH相同的三种酸溶液①HCOOH ②HCN ③HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的顺序是_______ (用序号表示)。
(2)25℃已知某浓度的HCOONa溶液pH=9,原因是_______ 。(用离子方程式表示),该溶液中由水电离出的OH-浓度为_______ 。
(3)浓度相同的四种溶液①HCOONa ②NaCN ③NaHCO3 ④Na2CO3,其碱性由强到弱的顺序是_______ (用序号表示);其中HCOONa溶液中各离子浓度由大到小的顺序是_______ 。
(4)浓度均为0.1mol·L-1三种溶液①HCOONH4、②NH4CN、③NH4HCO3,这三种溶液中c(NH )从大到小的顺序为
)从大到小的顺序为_______ (用序号表示)。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25°C) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)体积相同、pH相同的三种酸溶液①HCOOH ②HCN ③HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的顺序是
(2)25℃已知某浓度的HCOONa溶液pH=9,原因是
(3)浓度相同的四种溶液①HCOONa ②NaCN ③NaHCO3 ④Na2CO3,其碱性由强到弱的顺序是
(4)浓度均为0.1mol·L-1三种溶液①HCOONH4、②NH4CN、③NH4HCO3,这三种溶液中c(NH
 )从大到小的顺序为
)从大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】我们的生活离不开化学,化学物质在不同的领域发挥着重要的作用。根据要求回答下列问题:
(1)25℃时,求下列溶液的pH。
①0.05mol/L的H2SO4溶液,其pH为_______ 。
②pH=11的NaOH溶液加水稀释10倍,其pH为_______ 。
③pH=4的醋酸溶液和pH=10的NaOH溶液等体积混合,混合后的pH_______ 7(填“>”“<”“=”)。
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl﹣),则溶液显
)=c(Cl﹣),则溶液显_______ (填“酸”“碱”或“中”)性。
(3)向FeCl3溶液中加入少量NaHCO3,产生的现象为_______ ,用离子方程式表示其原因_______ 。
(4)不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是_______ 。
(5)常温下,0.1mol/L的盐酸溶液中,由水电离出来氢离子浓度为_______ 。
(6)明矾是常用的一种净水剂,用离子方程式和相应的文字叙述解释其净水的原理:_______ 。
(7)泡沫灭火器的灭火原理:_______ (用离子方程式和相应的文字叙述解释)。
(8)铵盐是重要的化肥,NH4Cl溶液中离子浓度大小顺序是_______ 。
(1)25℃时,求下列溶液的pH。
①0.05mol/L的H2SO4溶液,其pH为
②pH=11的NaOH溶液加水稀释10倍,其pH为
③pH=4的醋酸溶液和pH=10的NaOH溶液等体积混合,混合后的pH
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl﹣),则溶液显
)=c(Cl﹣),则溶液显(3)向FeCl3溶液中加入少量NaHCO3,产生的现象为
(4)不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是
(5)常温下,0.1mol/L的盐酸溶液中,由水电离出来氢离子浓度为
(6)明矾是常用的一种净水剂,用离子方程式和相应的文字叙述解释其净水的原理:
(7)泡沫灭火器的灭火原理:
(8)铵盐是重要的化肥,NH4Cl溶液中离子浓度大小顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ、氮肥的使用在提高粮食产量的同时,也导致了土壤、水体污染等环境问题。
(1)长期过量使用铵态化肥NH4Cl,易导致土壤酸化,请用化学用语解释原因________________
(2)工业上处理氨氮废水的方法是采用电解法将NO 转化为N2,如图所示
转化为N2,如图所示


B极的电极反应方程式是_________________________
(3)除去60L废水中的62 mg NO 后, 废水的pH=
后, 废水的pH=_______ 。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色。
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为__________ 。
(2)欲用(丙)装置给铜镀银,银应该是_________ 电极(填G或H)。
(3)(丁)装置中Y极附近红褐色变__________ (填深或浅)。
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为______________ 。
(1)长期过量使用铵态化肥NH4Cl,易导致土壤酸化,请用化学用语解释原因
(2)工业上处理氨氮废水的方法是采用电解法将NO
 转化为N2,如图所示
转化为N2,如图所示

B极的电极反应方程式是
(3)除去60L废水中的62 mg NO
 后, 废水的pH=
后, 废水的pH=Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色。
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为
(2)欲用(丙)装置给铜镀银,银应该是
(3)(丁)装置中Y极附近红褐色变
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液的pH>7,用离子方程式表示原因___ 。
(2)某小组同学把饱和的NaClO溶液和饱和的KAl(SO4)2溶液混合反应,发现产生大量的白色胶状沉淀,同时生成一种有漂白、杀菌作用的物质。反应的离子方程式是___ 。
(3)已知在常温下测得浓度均为0.1mol•L-1的下列5种溶液的pH:
则下列离子CH3COO-,HCO ,CO
,CO ,ClO-,CN-结合质子(H+)的能力最强的是
,ClO-,CN-结合质子(H+)的能力最强的是___ 。
Ⅱ.请回答下列问题(注意:溶液混合时,均忽略溶液体积变化):
(4)25℃时,pH=2的盐酸溶液与pH=4的H2SO4溶液等体积混合,求混合后的pH=__ 。
(5)25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,充分混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为__ 。
(6)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则 等于
等于__ 。
Ⅲ.25℃时,现有浓度均为0.1mol.L-1的下列溶液:①盐酸,②醋酸,③硫酸。请回答下列问题:
(7)等浓度,等体积的①、②、③三种溶液,用等物质的量浓度的NaOH溶液恰好完全中和时,消耗NaOH溶液的体积由大到小顺序为__ 。
(8)等体积,等pH①、②、③三种溶液,分别加入形状大小相同的镁片,开始产生气泡的速率由快到慢的关系为__ 。
(1)NaClO溶液的pH>7,用离子方程式表示原因
(2)某小组同学把饱和的NaClO溶液和饱和的KAl(SO4)2溶液混合反应,发现产生大量的白色胶状沉淀,同时生成一种有漂白、杀菌作用的物质。反应的离子方程式是
(3)已知在常温下测得浓度均为0.1mol•L-1的下列5种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
则下列离子CH3COO-,HCO
 ,CO
,CO ,ClO-,CN-结合质子(H+)的能力最强的是
,ClO-,CN-结合质子(H+)的能力最强的是Ⅱ.请回答下列问题(注意:溶液混合时,均忽略溶液体积变化):
(4)25℃时,pH=2的盐酸溶液与pH=4的H2SO4溶液等体积混合,求混合后的pH=
(5)25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,充分混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为
(6)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则
 等于
等于Ⅲ.25℃时,现有浓度均为0.1mol.L-1的下列溶液:①盐酸,②醋酸,③硫酸。请回答下列问题:
(7)等浓度,等体积的①、②、③三种溶液,用等物质的量浓度的NaOH溶液恰好完全中和时,消耗NaOH溶液的体积由大到小顺序为
(8)等体积,等pH①、②、③三种溶液,分别加入形状大小相同的镁片,开始产生气泡的速率由快到慢的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】实验室配制有0.1mol/L的Na2CO3溶液,根据电离平衡和水解知识,回答下列有关问题:
(1)写出H2CO3的电离方程式为_________________________________ ;
(2)Na2CO3溶液显碱性,原因是(用离子方程式表示)
__________________________________________________________ ;
(3)在该溶液中,c(Na+)、c(CO32-) 、c(H+)、c(HCO3-)、c(OH-)的大小关系为
____________________________________________________________ ;
(4)根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)=____________________________________ ;
(5)根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)=_______________________________________________ 。
(1)写出H2CO3的电离方程式为
(2)Na2CO3溶液显碱性,原因是(用离子方程式表示)
(3)在该溶液中,c(Na+)、c(CO32-) 、c(H+)、c(HCO3-)、c(OH-)的大小关系为
(4)根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)=
(5)根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】水溶液中存在离子平衡,请回答下列问题:
(1) 水溶液呈
水溶液呈_____ (填“酸”“中”或“碱”)性,原因是__________ (用离子方程式表示)。
(2)已知T℃时,纯水中 ,则
,则
①该温度时0.1mol/LNaOH溶液的pH为_____ 。
②该温度下,将pH=2的 溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为
溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为_____ 。
③该温度下,若1体积 的某强酸溶液与10体积
的某强酸溶液与10体积 的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是
的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是_____ 。
(3)常温下,向25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示。

①该氢氧化钠溶液的浓度为_____ mol/L。
②在B点,溶液中离子浓度大小关系为_____ 。
③在D点,
_____ (填“<”“>”或“=”) 。
。
(1)
 水溶液呈
水溶液呈(2)已知T℃时,纯水中
 ,则
,则①该温度时0.1mol/LNaOH溶液的pH为
②该温度下,将pH=2的
 溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为
溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为③该温度下,若1体积
 的某强酸溶液与10体积
的某强酸溶液与10体积 的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是
的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是(3)常温下,向25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示。

①该氢氧化钠溶液的浓度为
②在B点,溶液中离子浓度大小关系为
③在D点,

 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】25℃时有以下5种溶液:①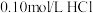 溶液:②
溶液:②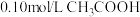 溶液:③
溶液:③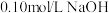 溶液:④
溶液:④ 溶液:⑤饱和
溶液:⑤饱和 溶液。
溶液。
(1)溶液①的
_______ 7(填“>”、“<”或者“=”)。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)①和②的溶液中水的电离程度为①_______ ②(填“>”、“<”或者“=”)。
(4)将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是_______ 。
(5)用广泛 试纸测得④的
试纸测得④的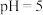 ,请结合化学用语对
,请结合化学用语对 溶液显酸性的原因进行完整说明
溶液显酸性的原因进行完整说明_______ 。
(6)加热⑤可制备 胶体,请结合化学用语解释
胶体,请结合化学用语解释_______ 。
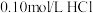 溶液:②
溶液:②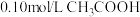 溶液:③
溶液:③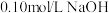 溶液:④
溶液:④ 溶液:⑤饱和
溶液:⑤饱和 溶液。
溶液。(1)溶液①的

(2)写出
 的电离方程式
的电离方程式(3)①和②的溶液中水的电离程度为①
(4)将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是
(5)用广泛
 试纸测得④的
试纸测得④的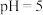 ,请结合化学用语对
,请结合化学用语对 溶液显酸性的原因进行完整说明
溶液显酸性的原因进行完整说明(6)加热⑤可制备
 胶体,请结合化学用语解释
胶体,请结合化学用语解释
您最近一年使用:0次
【推荐3】Ⅰ、H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。

(1)以酚酞为指示剂(变色范围pH8.0 ~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为______ 。
(2)pH=11时,图中H3AsO3水溶液中三种微粒浓度由大到小顺序为______ ;
(3)H3AsO4第一步电离方程式为______ ;
(4)若pKa2=-1gHKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2=______ 。
Ⅱ、用0.1000mol•L-1AgNO3滴定50.00mL•L-3Cl-溶液的滴定曲线如图所示

(5)根据曲线数据计算可知Ksp(AgCl)数量级为______ ;
(6)相同实验条件下,若改为0.0400mol•L-1Cl-,反应终点c移到______ ;(填“a”、“b”或“d”)
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若给为0.0500mol•L-1Br-,反应终点c向______ 方向移动(填“a”、“b”或“d”)。

(1)以酚酞为指示剂(变色范围pH8.0 ~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
(2)pH=11时,图中H3AsO3水溶液中三种微粒浓度由大到小顺序为
(3)H3AsO4第一步电离方程式为
(4)若pKa2=-1gHKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2=
Ⅱ、用0.1000mol•L-1AgNO3滴定50.00mL•L-3Cl-溶液的滴定曲线如图所示

(5)根据曲线数据计算可知Ksp(AgCl)数量级为
(6)相同实验条件下,若改为0.0400mol•L-1Cl-,反应终点c移到
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若给为0.0500mol•L-1Br-,反应终点c向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】铈、钛、锌、锰虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,反应中CeO2作______ 剂。在加热条件下,CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______ 。
(2)钛(Ti)被誉为“二十一世纪的金属”。
①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体。该反应的化学方程式是______ 。
②加热条件下,镁与TiCl4反应可得到钛,下列气体可以作为保护气的是______
A.O2 B. N2 C. CO2 D.Ar
(3)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。写出锌和氢氧化钠溶液反应的化学方程式______ 。
(4)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料。
①已知A~G各物质间的关系如图,其中B、D为气态单质。
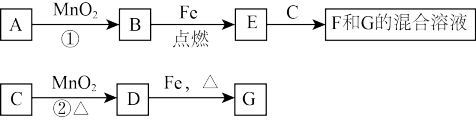
则反应②的离子方程式为______ 。
②E和C反应的化学方程式______ 。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,反应中CeO2作
(2)钛(Ti)被誉为“二十一世纪的金属”。
①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体。该反应的化学方程式是
②加热条件下,镁与TiCl4反应可得到钛,下列气体可以作为保护气的是
A.O2 B. N2 C. CO2 D.Ar
(3)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。写出锌和氢氧化钠溶液反应的化学方程式
(4)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料。
①已知A~G各物质间的关系如图,其中B、D为气态单质。

则反应②的离子方程式为
②E和C反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】运用盐类水解知识回答下列问题:
(1)FeCl3溶液可用作净水剂,原理为(用必要的化学用语和相关文字说明)______ 。
(2)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是______ 。实验室配制0.01 mol·L-1 FeCl3溶液时,为了抑制FeCl3水解使溶液中不产生沉淀,可加入少量盐酸至溶液pH不大于______ 。 [Fe(OH)3的 ]
]
(3)泡沫灭火器灭火时发生反应的离子方程式是______ 。
(4)25℃时,pH=11的KOH溶液和pH=11的K2CO3溶液中,由水电离出的c(OH−)的比值为______ 。
(1)FeCl3溶液可用作净水剂,原理为(用必要的化学用语和相关文字说明)
(2)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是
 ]
](3)泡沫灭火器灭火时发生反应的离子方程式是
(4)25℃时,pH=11的KOH溶液和pH=11的K2CO3溶液中,由水电离出的c(OH−)的比值为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)FeCl3 具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3 高效。请回答下列问题:
(已知25℃,Ksp[Fe(OH)3]=4.0×10-38)FeCl3净水的原理是________ (用离子方程式表示)。
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________ ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________ 。
(3)工业上由CuCl2·2H2O晶体制备无水CuCl2的合理方法是在HCl气氛中加热,若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(文字说明)________ 。
(已知25℃,Ksp[Fe(OH)3]=4.0×10-38)FeCl3净水的原理是
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入
(3)工业上由CuCl2·2H2O晶体制备无水CuCl2的合理方法是在HCl气氛中加热,若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(文字说明)
您最近一年使用:0次



