1 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图。
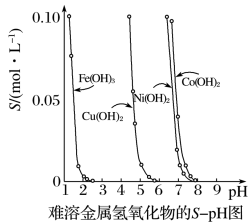
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为___________ 。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式___________ 。
(5)已知一些难溶物的溶度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___________ 除去它们。(选填序号)
A.NaOH B.FeS C.Na2S

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式
(5)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
2022-01-17更新
|
344次组卷
|
13卷引用:选择性必修1 专题3 第四单元综合训练
选择性必修1 专题3 第四单元综合训练(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)同步君 选修4 第3章第4节 难溶电解质的溶解平衡高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题(已下线)2019年11月24日《每日一题》高二化学人教版(选修4)—— 每周一测鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮四川省绵阳市盐亭中学2021-2022学年高二下学期第三次月考化学试题
20-21高二下·四川绵阳·阶段练习
名校
2 . 下列说法中,正确的是
| A.25 ℃时,在含有大量PbI2的饱和溶液中加入KI溶液,溶液中Pb2+浓度增大 |
| B.常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 |
| C.两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 |
您最近一年使用:0次
2021-09-09更新
|
776次组卷
|
4卷引用:第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)四川省江油中学2020-2021学年高二下学期4月月考化学试题(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题
名校
解题方法
3 . 已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO )。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
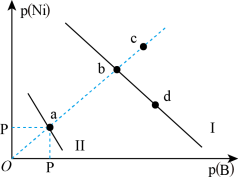
 )。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
| A.常温下NiCO3的溶解度大于NiS的溶解度 |
| B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动 |
| C.对于曲线Ⅰ,在b点加热,b点向c点移动 |
D.P为3.5且对应的阴离子是CO |
您最近一年使用:0次
2021-09-05更新
|
3065次组卷
|
42卷引用:选择性必修1 化学反应原理综合训练
选择性必修1 化学反应原理综合训练(已下线)第三章 水溶液中的离子平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)选择性必修1(SJ)专题3专题培优专练(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2021年高考全国乙卷化学试题变式题陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题西北师大附中2018届下学期高三年级第二次模拟理综化学试卷西藏自治区拉萨中学2018届高三第七次月考理综化学试题【全国市级联考】河北省保定市2018届高三第二次模拟考试理科综合化学试题【全国市级联考】江西省南昌市2018届高三第三次模拟考试理综化学试题【全国百强校】广东省阳春市第一中学2018届高三第九次月考理综化学试题【市级联考】湖北省十堰市2019届高三下学期模拟化学试题四川省泸县第四中学2019届高三下学期三诊模拟理科综合化学试题辽宁省六校协作体2020届高三上学期期中考试化学试题步步为赢 高二化学寒假作业:综合检测(一)福建省厦门外国语学校2020届高三12月月考化学试题2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】吉林省梅河口市第五中学2020届高三下学期模拟考试化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编鲁科版(2019)选择性必修1化学反应原理 综合训练高中必刷题高二选择性必修1化学反应原理综合训练(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过素养 学科素养拓展训练人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 过素养 学科素养拓展训练山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题(已下线)【直击双一流】06-备战2022年高考化学名校进阶模拟卷(通用版)湖南省株洲市第一中学2021-2022学年高三下学期期中考试化学试题陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题
2013高二·河南·竞赛
解题方法
4 . 下列液体均处于常温,有关叙述正确的是
| A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.不能用玻璃试剂瓶盛放NH4F溶液,由此推测该溶液呈酸性 |
| C.AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COOO-) |
您最近一年使用:0次
2016高二·安徽·竞赛
5 . 常温下CaSO4(Ksp=9×10-6)在水中的沉淀溶解平衡曲线如图,下列判断错误 的是
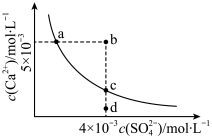

| A.a、c两点均可以表示常温下CaSO4在水溶液中形成的饱和溶液 |
| B.a点对应的Ksp等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO )一定等于3×10-3mol·L-1 )一定等于3×10-3mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
您最近一年使用:0次
解题方法
6 . 工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和 溶液浸泡水垢,将水垢中的
溶液浸泡水垢,将水垢中的 转化为
转化为 ,再用盐酸除去[已知常温下:
,再用盐酸除去[已知常温下: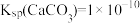 ,
,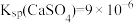 ]。下列说法错误的是
]。下列说法错误的是
 溶液浸泡水垢,将水垢中的
溶液浸泡水垢,将水垢中的 转化为
转化为 ,再用盐酸除去[已知常温下:
,再用盐酸除去[已知常温下: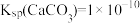 ,
,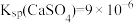 ]。下列说法错误的是
]。下列说法错误的是A.温度升高, 溶液的 溶液的 和 和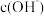 均会增大 均会增大 |
B.沉淀转化的离子方程式为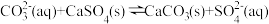 |
C.该条件下, 的溶解度约为 的溶解度约为 大于 大于 |
D. 和共存的 和共存的 悬浊液中, 悬浊液中,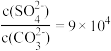 |
您最近一年使用:0次
2021-08-07更新
|
380次组卷
|
5卷引用:选择性必修1 专题3 第四单元综合训练
选择性必修1 专题3 第四单元综合训练(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)
20-21高二·全国·课时练习
名校
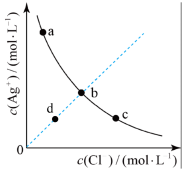
7 . 一定温度下,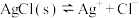 体系中,
体系中,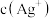 和
和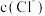 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
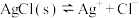 体系中,
体系中,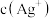 和
和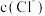 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.a、b、c三点对应的 相等 相等 |
| B.d点的溶液为AgCl的不饱和溶液 |
| C.向该平衡体系中加入NaCl固体,不会有AgCl沉淀析出 |
D.AgCl溶于水形成的饱和溶液中,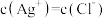 |
您最近一年使用:0次
2021-08-01更新
|
902次组卷
|
5卷引用:第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)选择性必修1(SJ)专题3第四单元 沉淀溶解平衡(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)3.4.1沉淀溶解平衡原理 课后云南省楚雄第一中学2022-2023学年高二下学期期末考试化学试题
20-21高二上·吉林松原·期中
名校
解题方法
8 . 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

| A.在AgBr饱和溶液中加入AgNO3固体,可使溶液由a点到c点 |
| B.在t℃时,AgBr的Ksp为4.9×10-13 |
| C.图中b点对应的是AgBr的过饱和溶液,有固体析出 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816 AgBr(s)+Cl-(aq)的平衡常数K≈816 |
您最近一年使用:0次
2021-01-09更新
|
805次组卷
|
8卷引用:第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)吉林省长春市农安县2020-2021学年高二上学期期末考试化学试题内蒙古包头市2020-2021学年高二上学期期末考试化学试题课时1 沉淀溶解平衡及其应用吉林省松原市前郭尔罗斯蒙古族中学2020-2021学年高二上学期期中考试化学试题吉林省前郭尔罗斯蒙古族自治县蒙古族中学2020-2021年度高二上学期期中考试化学试题陕西省西安市2023-2024学年高二上学期期末化学测试卷B四川省什邡中学2023-2024学年高二下学期4月第一次月考化学试题
9 . 下列说法正确的是
| A.AgCl难溶于水,溶液中没有Ag+和Cl﹣ |
| B.温度一定时,当AgCl水溶液中Ag+和Cl﹣浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| C.AgCl水溶液的导电性很弱,所以AgCl为弱电解质 |
| D.向饱和AgCl水溶液中加入盐酸,c(Cl﹣)增大,Ksp值变大 |
您最近一年使用:0次
名校
10 . 向浓度均为0.010mol/L的Na2CrO4、NaBr和NaCl的混合溶液中逐滴加入0.010mol/L的AgNO3溶液[已知Ksp(AgCl)=1.77×10-10mol2·L-2, Ksp(Ag2CrO4)=1.12×10-12mol3·L-3, Ksp(AgBr)=5.35×10-13mol2·L-2,Ag2CrO4显砖红色]。下列叙述正确的是( )
| A.原溶液中n(Na+)=0.040mol |
| B. Na2CrO4可用作AgNO3溶液滴定Cl-或Br-的指示剂 |
| C.生成沉淀的先后顺序是AgBr→Ag2CrO4→AgCl |
| D.出现 Ag2CrO4沉淀时,溶液中c(Cl-):c(Br-)=117:535 |
您最近一年使用:0次
2020-09-14更新
|
1681次组卷
|
12卷引用:选择性必修1 专题3素养检测
选择性必修1 专题3素养检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)第三章 水溶液中的离子平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)河南省洛阳市2018届高三上学期第一次质量预测(1月)化学试题河南省郑州市2018届高三高中毕业班第一次质量检测(模拟)化学试题(已下线)二轮复习测试专项-专题10 电解质溶液与离子平衡湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题12 溶度积的应用复习题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题(已下线)3.4.2 沉淀溶解平衡原理的应用(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)



