19-20高三·云南昆明·阶段练习
1 . 为研究用 溶液将混合溶液中的
溶液将混合溶液中的 和
和 沉淀分离,绘制了25℃时AgCl和
沉淀分离,绘制了25℃时AgCl和 两种难溶化合物的溶解平衡曲线。其中,
两种难溶化合物的溶解平衡曲线。其中, ,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
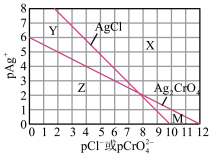
 溶液将混合溶液中的
溶液将混合溶液中的 和
和 沉淀分离,绘制了25℃时AgCl和
沉淀分离,绘制了25℃时AgCl和 两种难溶化合物的溶解平衡曲线。其中,
两种难溶化合物的溶解平衡曲线。其中, ,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
A.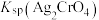 约为 约为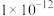 , ,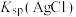 的数量级为 的数量级为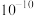 |
B.M区域内可析出 沉淀,而不析出AgCl沉淀 沉淀,而不析出AgCl沉淀 |
C.向 、 、 均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 |
D.向 、AgCl混合固体和水的溶解平衡体系中加少量水, 、AgCl混合固体和水的溶解平衡体系中加少量水, 增大 增大 |
您最近一年使用:0次
2023-01-13更新
|
497次组卷
|
11卷引用:第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测
(已下线)第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测2020届高三《新题速递·化学》12月第02期(考点07-11)2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】(已下线)第6讲 沉淀溶解平衡图像分析云南省昆明市第一中学2019-2020高三第三次双基检测化学试题广东省韶关市2020届高三下学期线上教学摸底自测化学试题山西省临汾市2020届高考考前适应性训练考试(一)理综化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第三次考试化学试题浙江省余姚中学2022-2023学年高二下学期期中考试 化学试题黑龙江省大庆市大庆中学2022-2023学年高三第二次模拟考试化学试题
2021高二·全国·专题练习
解题方法
2 . 向含有AgI固体的饱和溶液中:
(1)加入固体AgNO3,则c(I-)___________ (填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)将___________ 。
(3)若改加AgBr固体,则c(I-)___________ ,而c(Ag+)___________ 。
(1)加入固体AgNO3,则c(I-)
(2)若改加更多的AgI,则c(Ag+)将
(3)若改加AgBr固体,则c(I-)
您最近一年使用:0次
2021高二·全国·专题练习
3 . 回答下列问题
(1)18 ℃时,Mg(OH)2的Ksp=1.8×10-11,其饱和溶液中Mg2+的物质的量浓度是___________ 。
(2)已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s) 3Ca2+(aq)+2PO
3Ca2+(aq)+2PO (aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO
(aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO )=1.58×10-6 mol·L-1,则Ksp=
)=1.58×10-6 mol·L-1,则Ksp=___________ 。
(1)18 ℃时,Mg(OH)2的Ksp=1.8×10-11,其饱和溶液中Mg2+的物质的量浓度是
(2)已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)
 3Ca2+(aq)+2PO
3Ca2+(aq)+2PO (aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO
(aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO )=1.58×10-6 mol·L-1,则Ksp=
)=1.58×10-6 mol·L-1,则Ksp=
您最近一年使用:0次
2021高二·全国·专题练习
解题方法
4 . 痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37 ℃时,Ka=4.0×10-6)
②NaUr(s) ⇌Ur-(aq)+Na+(aq)
(1)37 ℃时,1.0 L水中最多可溶解8.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为_______ 。
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp_______ (填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是_______ (填“放热”或“吸热”)反应。
(3)37 ℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为5.0×10-4 mol·L-1,该病人尿液的c(H+)为_______ ,pH_______ 7(填“>”、“<”或“=”)。
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37 ℃时,Ka=4.0×10-6)
②NaUr(s) ⇌Ur-(aq)+Na+(aq)
(1)37 ℃时,1.0 L水中最多可溶解8.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp
(3)37 ℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为5.0×10-4 mol·L-1,该病人尿液的c(H+)为
您最近一年使用:0次
2022-01-17更新
|
797次组卷
|
3卷引用:专题3 溶液中的离子反应 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)专题3 溶液中的离子反应 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)第四节 沉淀溶解平衡 第1课时 难溶电解质的沉淀溶解平衡第三章 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用
2021高二·全国·专题练习
解题方法
5 . 含有较多Ca2+、Mg2+和HCO 的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水。现有一锅炉厂使用这种水,试判断其水垢的主要成分为(已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=5.6×10-12)
的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水。现有一锅炉厂使用这种水,试判断其水垢的主要成分为(已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=5.6×10-12)
 的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水。现有一锅炉厂使用这种水,试判断其水垢的主要成分为(已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=5.6×10-12)
的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水。现有一锅炉厂使用这种水,试判断其水垢的主要成分为(已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=5.6×10-12)| A.CaO、MgO | B.CaCO3、MgCO3 |
| C.CaCO3、Mg(OH)2 | D.CaCO3、MgO |
您最近一年使用:0次
11-12高二上·辽宁锦州·期末
6 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图。
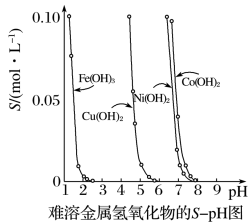
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为___________ 。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式___________ 。
(5)已知一些难溶物的溶度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___________ 除去它们。(选填序号)
A.NaOH B.FeS C.Na2S

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式
(5)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
2022-01-17更新
|
344次组卷
|
13卷引用:3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)2019年11月24日《每日一题》高二化学人教版(选修4)—— 每周一测选择性必修1 专题3 第四单元综合训练福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)同步君 选修4 第3章第4节 难溶电解质的溶解平衡高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮四川省绵阳市盐亭中学2021-2022学年高二下学期第三次月考化学试题
2021高二·全国·专题练习
解题方法
7 . 工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸除去[已知:Ksp(CaCO3)=1×10-10,Ksp(CaSO4)=9×10-6],下列说法错误的是
| A.升高温度,Na2CO3溶液的Kw和c(OH-)均会增大 |
B.沉淀转化的离子方程式为 (aq)+CaSO4(s) (aq)+CaSO4(s) CaCO3(s)+ CaCO3(s)+ (aq) (aq) |
| C.该条件下,CaCO3溶解度约为1×10-3 g |
D.CaSO4和CaCO3共存的悬浊液中,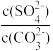 =9×104 =9×104 |
您最近一年使用:0次
2021高二·全国·专题练习
8 . 一定温度一定量的水中,石灰乳悬浊液存在溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰,下列说法正确的是
 Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰,下列说法正确的是| A.n(Ca2+)增大 | B.c(Ca2+)增大 | C.n(OH-)增大 | D.c(OH-)不变 |
您最近一年使用:0次
2021高二·全国·专题练习
名校
9 . 下列物质的溶解度随温度升高而减小的是
①KNO3 ②Ca(OH)2 ③BaSO4 ④CO2
①KNO3 ②Ca(OH)2 ③BaSO4 ④CO2
| A.①② | B.②④ | C.①③ | D.①④ |
您最近一年使用:0次
2022-01-16更新
|
115次组卷
|
4卷引用:3.4.1 沉淀溶解平衡原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)3.4.1 沉淀溶解平衡原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)第1课时 沉淀溶解平衡与溶度积云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题课时1难溶电解质的沉淀溶解平衡课堂例题
21-22高三上·广东深圳·阶段练习
名校
解题方法
10 . 25℃时,lgS(CaF2)随pH变化如图所示,下列说法错误的是
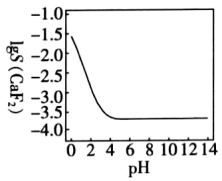
已知:S(CaF2)(单位:mol·L−1)表示CaF2的溶解度。

已知:S(CaF2)(单位:mol·L−1)表示CaF2的溶解度。
| A.CaF2饱和溶液中2c(Ca2+)=c(F-)+c(HF) |
| B.已知Ksp(CaF2)=4×10-11.1,则水中S(CaF2)=10-3.7mol·L-1 |
| C.pH变化时,CaF2溶液中始终存在:c(F-)>c(Ca2+) |
| D.当pH<7时,2c(Ca2+)+c(H+)>c(F-)+c(OH-) |
您最近一年使用:0次
2021-12-25更新
|
764次组卷
|
12卷引用:3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)广东省深圳大学附属中学2022届高三9月调研考试化学试题福建省南平市2022届高三10月联考化学试卷甘肃省白银市靖远县第四中学2022届高三10月月考化学试题河北省河北衡水中学2021届高三下学期第一次调研考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】08山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题河北省邯郸市永年区第二中学2021-2022学年高二12月月考化学试题甘肃省高台县第一中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题安徽省宿州市萧县鹏程中学2021-2022学年高二下学期第一次质量检测化学试题



