名校
1 . 已知:常温下, 溶液的电离平衡常数
溶液的电离平衡常数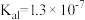 ,
,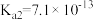 ,
, 、
、 的
的 分别为
分别为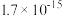 、
、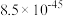 ,
,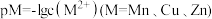 ,
, ,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线
,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线 表示
表示 。下列说法错误的是
。下列说法错误的是
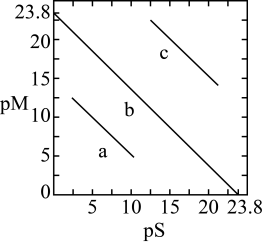
 溶液的电离平衡常数
溶液的电离平衡常数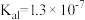 ,
,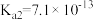 ,
, 、
、 的
的 分别为
分别为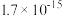 、
、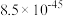 ,
,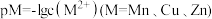 ,
, ,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线
,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线 表示
表示 。下列说法错误的是
。下列说法错误的是
A.曲线 表示 表示 |
B.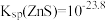 |
C.将浓度均为 的 的 溶液和 溶液和 溶液等体积混合,有沉淀产生 溶液等体积混合,有沉淀产生 |
D.含 和 和 的悬浊液中: 的悬浊液中: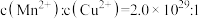 |
您最近一年使用:0次
2020-12-18更新
|
1603次组卷
|
4卷引用:小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)难点6 水溶液中的四大平衡常数-2021年高考化学专练【热点·重点·难点】湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题福建省莆田市2021届高三毕业班第一次教学质量检测化学试卷
13-14高三上·湖北黄冈·期末
名校
解题方法
2 . 化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=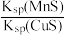 |
您最近一年使用:0次
2020-12-16更新
|
906次组卷
|
38卷引用:押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(已下线)2019年11月19日《每日一题》高二化学人教版(选修4)—— 沉淀溶解平衡在物质分离中的应用(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省咸阳市秦都区2021-2022学年高二上学期期末考试化学试题(已下线)第5讲 难溶电解质的溶解平衡(已下线)2013届湖北省黄冈市高三上学期期末考试理综化学试卷(已下线)2013-2014学年江西省鹰潭一中高二上学期期中考试化学试卷(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(已下线)2013-2014四川省攀枝花市高三5月模拟考试理综化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题内蒙古集宁一中西校区2017-2018学年高二上学期期中考试化学试题福建省福州市长乐高级中学2020届高三上学期第一次月考化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(普通班)四川省广元川师大万达中学2019-2020学年高二上学期期末教学质量检测化学试题云南省丽江市华坪县第一中学2019—2020学年高二上学期期末考试化学试题辽宁省抚顺市六校协作体2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市宾县第一中学2019-2020学年高二上学期期末考试化学试题湖南省长沙市雨花区2019-2020学年高二上学期期末考试化学(选考)试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期期中考试化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题黑龙江省哈尔滨市延寿县第二中学2020-2021学年高二11月月考化学试题安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用上海市行知中学2022-2023学年高二下学期2月月考化学试题青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷
20-21高二上·全国·课时练习
解题方法
3 . 一定温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是


| A.加入BaCl2固体,不能使溶液由d点变到b点 |
| B.通过蒸发可以使溶液由a点变到c点 |
| C.降低温度可以使溶液由e点变到c点 |
| D.a、c点对应的Ksp不同 |
您最近一年使用:0次
2020-12-12更新
|
1399次组卷
|
5卷引用:2021年高考全国甲卷化学试题变式题
(已下线)2021年高考全国甲卷化学试题变式题河北省迁安市2020-2021学年高二上学期期末考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河南省驻马店市2021-2022学年高二上学期期末考试化学试题微专题(九)——沉淀溶解平衡曲线
2020高三·全国·专题练习
解题方法
4 . 按要求完成下列填空。
(1)(溶解度与Ksp的换算)已知某温度时Ksp(CaCO3)=1×10-10,则该温度下,CaCO3的溶解度约为________ 。
(2)(平衡常数与Ksp的关系)在1.0 L Na2CO3溶液中溶解0.01 mol BaSO4,计算Na2CO3溶液的最初浓度不得低于________ mol·L-1(忽略溶液体积变化)[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9]。
(3)(Ksp与Ka的计算关系)汽车尾气中的SO2可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液的pH为9,忽略SO 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=________ (保留3位有效数字)[已知:Ka1(H2SO3)=1.54×10-2,Ka2(H2SO3)=1.02×10-7]。
(1)(溶解度与Ksp的换算)已知某温度时Ksp(CaCO3)=1×10-10,则该温度下,CaCO3的溶解度约为
(2)(平衡常数与Ksp的关系)在1.0 L Na2CO3溶液中溶解0.01 mol BaSO4,计算Na2CO3溶液的最初浓度不得低于
(3)(Ksp与Ka的计算关系)汽车尾气中的SO2可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液的pH为9,忽略SO
 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
5 . 常温下,将11.65 g BaSO4粉末置于盛有250 mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )


| A.相同温度时,Ksp(BaSO4)>Ksp(BaCO3) |
| B.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 |
| C.若使0.05 mol BaSO4全部转化为BaCO3,至少要加入1.25 mol Na2CO3 |
D.0.05 mol BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为c( )>c( )>c( )>c(OH-)>c(Ba2+) )>c(OH-)>c(Ba2+) |
您最近一年使用:0次
名校
解题方法
6 . I 、H2A在水中存在以下平衡:H2A  H+ +HA- ,HA-
H+ +HA- ,HA- H+ +A2-
H+ +A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________ 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是__________ 。
A.c(Na+ )>c(K+ ) B. c(H +)•c(OH )=1×10-14
C. c(Na+ )=c(K+ ) D. c(Na+ )+c(K+ )=c(HA- )+c(A2-)
Ⅱ、含有Cr2O 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O
的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:
Cr2O
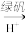 Cr3+、Fe3+
Cr3+、Fe3+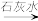 Cr(O3)、Fe(OH)3
Cr(O3)、Fe(OH)3
(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为:________________ 。
(4)欲使25 L该废水中 转化为Cr3+,理论上需要加入
转化为Cr3+,理论上需要加入_________ g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+ 的浓度为_________ mol/L ,Cr3+________ (填是或否)沉淀完全。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III. 已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为_______________
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是_____ g/kg。(以含w的代数式表示)
 H+ +HA- ,HA-
H+ +HA- ,HA- H+ +A2-
H+ +A2-(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是
A.c(Na+ )>c(K+ ) B. c(H +)•c(OH )=1×10-14
C. c(Na+ )=c(K+ ) D. c(Na+ )+c(K+ )=c(HA- )+c(A2-)
Ⅱ、含有Cr2O
 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O
的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:Cr2O

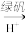 Cr3+、Fe3+
Cr3+、Fe3+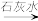 Cr(O3)、Fe(OH)3
Cr(O3)、Fe(OH)3(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为:
(4)欲使25 L该废水中
 转化为Cr3+,理论上需要加入
转化为Cr3+,理论上需要加入(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+ 的浓度为
III. 已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是
您最近一年使用:0次
名校
解题方法
7 . 在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO )=Ksp,c(Ba2+)>c(SO ) ) |
B.c(Ba2+)=c(SO )= )=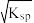 |
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO )>Ksp,c(Ba2+)=c(SO ) ) |
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO )≠Ksp,c(Ba2+)<c(SO ) ) |
您最近一年使用:0次
2020-11-11更新
|
640次组卷
|
18卷引用:3.4.1 难溶电解质的沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
(已下线)3.4.1 难溶电解质的沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)2018版化学(苏教版)高考总复习专题八课时跟踪训练--难溶电解质的沉淀溶解平衡福建省莆田第七中学2020-2021学年高二下学期期中考试化学(B卷)试题选择性必修1(SJ)专题3第四单元 沉淀溶解平衡2014-2015河北枣强中学高二上学期期末考试化学试卷湖南省长沙市长郡中学2017-2018学年度高二第一学期期末考试化学试题新疆自治区昌吉市第九中学2018-2019学年高二上学期第二次月考化学试题福建省三明市第一中学2020届高三上学期第一次月考化学试题重庆市万州新田中学2019-2020学年高二上学期期中考试化学试题陕西省西安中学2019-2020学年高二12月月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考(实验班)化学试题甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考化学试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡甘肃省永昌县第一高级中学2021-2022学年高二上学期期末考试化学试题(已下线)3.4 沉淀溶解平衡-同步学习必备知识3.4.1沉淀溶解平衡原理 课中河北省保定市唐县第一中学2022-2023学年高二上学期10月期中考试化学试题陕西省/渭南市蒲城县尧山中学2023-2024学年高二上学期第三次月考化学试题
解题方法
8 . 下列叙述正确的是( )
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| B.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| C.25 ℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度增大 |
| D.为确定二元酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
您最近一年使用:0次
9 . ①已知t℃时AgCl的Ksp=2.0×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
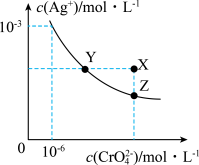

| A.在t℃时,Ag2CrO4的Ksp为1.0×10-12 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到Z点 |
C.在t℃时,以0.01mol·L-1AgNO3溶液滴定20.00mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液, 先沉淀 先沉淀 |
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+ 2AgCl(s)+ (aq)的平衡常数K=2.5×107 (aq)的平衡常数K=2.5×107 |
您最近一年使用:0次
2020-11-03更新
|
587次组卷
|
3卷引用:专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
(已下线)专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)甘肃省天水市第一中学2020-2021学年高二下学期开学考试化学试题重庆市秀山高级中学校2020-2021学年高二上学期10月月考化学试题
名校
解题方法
10 . 已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述正确的是
| A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| C.0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
| D.向AgCl的饱和溶液中加入NaCl晶体有AgCl析出,溶液中c(Ag+)仍与c(Cl-)相等 |
您最近一年使用:0次
2020-11-03更新
|
272次组卷
|
4卷引用:专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
(已下线)专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)重庆市秀山高级中学校2020-2021学年高二上学期10月月考化学试题上海市上海中学2022-2023学年高二上学期期中考试化学试题上海市新中高级中学2023-2024学年高二下学期阶段检测化学试题



