名校
解题方法
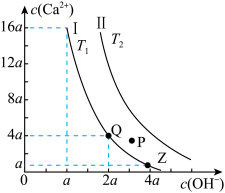
1 . 如图是Ca(OH)2在温度分别为T1、T2时的两种沉淀溶解平衡曲线(图中浓度单位为mol·L-1,与曲线Ⅰ对应的Ksp=4×10-6,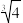 ≈1.6),下列说法中正确的是( )
≈1.6),下列说法中正确的是( )
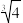 ≈1.6),下列说法中正确的是( )
≈1.6),下列说法中正确的是( )
| A.温度:T1<T2 |
| B.在温度为T1时,P点分散系中分散质粒子直径<1nm |
| C.加水稀释时溶液碱性减弱,Z点溶液可转化为Q点溶液 |
| D.Q点的溶液中c(OH-)约为0.0125mol·L-1 |
您最近一年使用:0次
2020-10-26更新
|
369次组卷
|
7卷引用:专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
(已下线)专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)江西省景德镇一中2020-2021学年高一下学期期末考试化学(2班)试题吉林省辽源第五中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】2. 2020 高二上 莲塘一中 期中考试 孙晖洪江西省南昌市第二中学2020-2021学年高二上学期第三次月考化学试题江西省抚州市黎川县第一中学2020-2021学年高二上学期第三次月考化学试题重庆市第七中学校2020-2021学年高二上学期12月考化学试题
解题方法
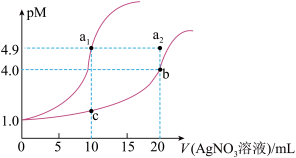
2 . 某温度下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K2CrO4溶液中分别滴加0.1 mol·L-1 AgNO3溶液。滴加过程中pM[pM=-lgM,M为c(Cl-)或c(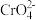 )]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为深红色沉淀,100.1≈1.259,
)]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为深红色沉淀,100.1≈1.259,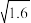 ≈1.265。下列说法错误的是( )
≈1.265。下列说法错误的是( )
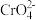 )]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为深红色沉淀,100.1≈1.259,
)]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为深红色沉淀,100.1≈1.259,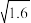 ≈1.265。下列说法错误的是( )
≈1.265。下列说法错误的是( )
| A.a1、b、c三点所示溶液中c(Ag+):b>c>a1 |
| B.若将上述NaCl溶液的浓度改为0.2 mol·L-1,则a1点会平移至a2点 |
| C.若将a1与b点溶液混合,则有AgCl与Ag2CrO4固体析出 |
| D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂 |
您最近一年使用:0次
名校
3 . 向浓度均为0.010mol/L的Na2CrO4、NaBr和NaCl的混合溶液中逐滴加入0.010mol/L的AgNO3溶液[已知Ksp(AgCl)=1.77×10-10mol2·L-2, Ksp(Ag2CrO4)=1.12×10-12mol3·L-3, Ksp(AgBr)=5.35×10-13mol2·L-2,Ag2CrO4显砖红色]。下列叙述正确的是( )
| A.原溶液中n(Na+)=0.040mol |
| B. Na2CrO4可用作AgNO3溶液滴定Cl-或Br-的指示剂 |
| C.生成沉淀的先后顺序是AgBr→Ag2CrO4→AgCl |
| D.出现 Ag2CrO4沉淀时,溶液中c(Cl-):c(Br-)=117:535 |
您最近一年使用:0次
2020-09-14更新
|
1690次组卷
|
12卷引用:押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)二轮复习测试专项-专题10 电解质溶液与离子平衡(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题选择性必修1 专题3素养检测河南省洛阳市2018届高三上学期第一次质量预测(1月)化学试题河南省郑州市2018届高三高中毕业班第一次质量检测(模拟)化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题12 溶度积的应用复习题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第三章 水溶液中的离子平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)3.4.2 沉淀溶解平衡原理的应用(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)
4 . 已知: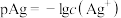 ,
,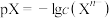 。
。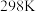 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:
 、
、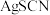 、
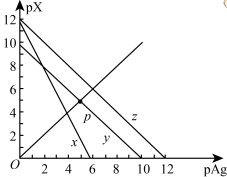
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
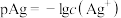 ,
,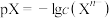 。
。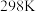 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:| 化学式 |  | 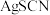 |  |
| 颜色 | 白 | 浅黄 | 红 |
 | 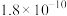 |  | 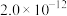 |
 、
、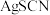 、
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
A.图中x代表 曲线,z代表 曲线,z代表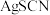 曲线 曲线 |
B.298K时,在 和 和 的物质的量浓度均为 的物质的量浓度均为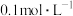 的溶液中,滴入少量 的溶液中,滴入少量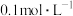 的 的 溶液,首先产生的是红色沉淀 溶液,首先产生的是红色沉淀 |
| C.298K时,若增大p点的阴离子浓度,则y上的点沿曲线向上移动 |
D.298K时, 的平衡常数 的平衡常数 |
您最近一年使用:0次
2020-09-13更新
|
1246次组卷
|
20卷引用:课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)
(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)2019年秋高三化学复习强化练习—— 难溶电解质的沉淀溶解平衡2020届高三《新题速递·化学》12月第01期(考点07-11)2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编选择性必修1 专题3 第四单元综合训练重庆市第一中学2020届高三10月月考理综化学试题贵州省铜仁市第一中学2020届高三上学期第三次月考化学试题黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题内蒙古赤峰市赤峰二中2019-2020学年高二下学期第一次月考化学试题陕西省西安中学2020届高三第六次模拟考试化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)陕西省汉中市部分高中2020-2021学年高二上学期12月月考化学试题福建省莆田二中2020-2021学年高三上学期期中检测化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题陕西省西安中学2022届高三下学期五月全仿真模拟考试(一)理综化学试题吉林省通化市辉南县第六中学2022-2023学年高二上学期第一次月考化学试题广西 南宁市第三中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
5 . 化学上常认为残留在溶液中的离子浓度≤1×10-5mol/L时,沉淀就已达完全。已知:常温下Ksp[M(OH)2]=1×10-21mol3/L3。则溶液中M2+沉淀完全时的pH最小值为
| A.7 | B.4 | C.5 | D.6 |
您最近一年使用:0次
2020-09-13更新
|
730次组卷
|
15卷引用:押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(A卷)课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)黑龙江省大庆市大庆十中、二中、二十三中、二十八中2017-2018学年高二第一次联考化学试题广东省深圳市罗湖区2017-2018学年高二上学期期末模拟化学试题甘肃省武威第十八中学2017-2018学年高二上学期期末考试化学试题江西省吉安县第三中学2017-2018学年高二1月月考化学试题宁夏吴忠中学2017-2018学年高二上学期期末考试化学试题宁夏吴忠市吴忠中学2017-2018学年第一学期高二化学期末考试试卷鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时2 Ksp图象及其相关计算高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时2 Ksp图像及其相关计算(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)3.4.2沉淀溶解平衡原理的应用 课中
名校
6 . 某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+)。所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法正确的是
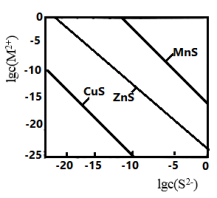

| A.三种离子对应的硫化物中Ksp(CuS)最小,约为1×10-20 |
| B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大 |
| C.可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2 |
| D.向浓度均为1×10-5mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Zn2+先沉淀 |
您最近一年使用:0次
2020-08-29更新
|
660次组卷
|
8卷引用:解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)湖北省武汉市新洲区城关高级中学2020-2021学年高二下学期开学收心考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)四川省绵阳南山中学2019-2020学年高二下学期6月月考化学试题云南省大理州祥云县2019-2020学年高二下学期期末统测化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题
名校
7 . 某温度下,向10mL的0.100mol·L-1CuCl2溶液中逐渐滴加0.100mol·L-1Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是( )
已知:lg2=0.3,Ksp(ZnS)=3.00×10-25mol2/L2

已知:lg2=0.3,Ksp(ZnS)=3.00×10-25mol2/L2

| A.a、b、c三点中,水的电离程度最大的为b点 |
| B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
| C.该温度下Ksp(CuS)=4.00×10-36mol2/L2 |
| D.向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-2mol•L-1Na2S溶液,Zn2+先沉淀 |
您最近一年使用:0次
2020-08-24更新
|
816次组卷
|
22卷引用:专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
(已下线)专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的电离及影响因素河南省宏力学校2020-2021学年高二上学期期末考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)河南省三门峡市渑池县第二高级中学2021-2022学年高二上学期第二次月考化学试题湖北省襄阳市第五中学2017届高三下学期第三次适应性考试化学试题河南省南阳市第一中学2017届高三第三次模拟考试化学试题福建省厦门外国语学校2017届高三适应性考试理综化学试题江西省临川二中2018届高三上学期第九次理综化学训练卷【全国百强校】湖北省沙市中学2018届高三高考冲刺考试理综化学试题【全国百强校】河北省武邑中学2019届高三上学期开学考试化学试题【全国百强校】山东省潍坊市第一中学2019届高三下学期2月(开学)考试理科综合化学试题【全国百强校】湖北省武汉市华中师范大学第一附属中学2018-2019学年高二上学期期末考试化学试题湖北省鄂州市2018-2019学年高二高中质量监测化学试题福建省三明市第一中学2020届高三上学期第一次月考化学试题吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题福建省南安第一中学2019-2020学年高二上学期第二次月考化学(选考)试题福建省师范大学附属中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测四川省成都市第七中学2020届高三上学期入学考试化学试题河北省石家庄市辛集市第一中学2019-2020学年高二上学期第三次月考化学试题重庆市缙云教育联盟2022-2023学年高二下学期6月期末考试化学试题
真题
名校
8 . 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
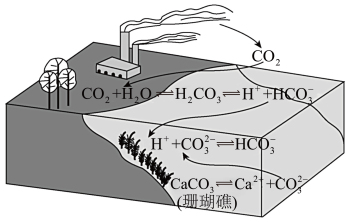

A.海水酸化能引起 浓度增大、 浓度增大、 浓度减小 浓度减小 |
| B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 |
C.CO2能引起海水酸化,其原理为  H++ H++ |
| D.使用太阳能、氢能等新能源可改善珊瑚的生存环境 |
您最近一年使用:0次
2020-07-08更新
|
12113次组卷
|
48卷引用:专题07 电解质溶液——备战2021年高考化学纠错笔记
(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)小题02 化学与社会生产生活环境(STSE)——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)第04讲 离子反应 离子方程式(精讲)-2022年一轮复习讲练测(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第4讲 离子反应 (讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)3.1 电离平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)考向24 弱电解质的电离平衡-备战2022年高考化学一轮复习考点微专题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编(已下线)专题01 STSE 化学用语-2020年高考真题和模拟题化学分项汇编(已下线)第06讲 离子反应 离子方程式(精讲)——2021年高考化学一轮复习讲练测上海市七宝中学2021届高三上学期期中考试化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题选择性必修1 专题3素养检测湖北省蕲春县2021-2022学年高二上学期期中考试化学试题江苏省徐州市王杰中学2021-2022学年高三10月学情调研化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题(已下线)第一部分 二轮专题突破 专题8 常见无机物性质的转化(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第52讲 难溶电解质的溶解平衡(已下线)题型64 碳及其化合物的性质(已下线)第7讲 碳、硅及无机非金属材料(已下线)第5讲 难溶电解质的溶解平衡2020年全国统一考试化学试题(新课标Ⅱ)吉林省长春市实验中学2020-2021学年高二上学期开学考试化学试题甘肃省武威第六中学2021届高三上学期第三次过关考试化学试题河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题2020年全国卷Ⅱ化学真题变式题天津市部分区2021-2022学年高三上学期期末考试化学试题湖南省娄底涟源市第一中学2022届高三下学期四月月考化学试题新疆喀什市普通高中2021-2022学年高三上学期期末考试化学试题四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题广东省广州市第一中学2022-2023学年高二上学期期末考试化学试题上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题上海师范大学附属中学宝山分校2023-2024学年高二上学期12月阶段性测试 化学(等级)试题
9 . 难溶电解质在水中达到沉淀溶解平衡时,下列说法中不正确的
| A.溶液中不存在难溶电解质离子 |
| B.沉淀的速率和溶解的速率相等 |
| C.继续加入难溶电解质,溶液中各离子浓度不变 |
| D.一定条件下可以转化为更难溶的物质 |
您最近一年使用:0次
10 . 常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L 悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌。加入Na2CO3固体的过程中溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是


| A.常温下,Ksp(BaSO4)=2.5×10-9 |
| B.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 |
| C.若要使BaSO4全部转化为BaCO3至少要加入0.65mol Na2CO3 |
D.BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小关系为:c( )>c( )>c( )>c(Ba2+)>c(OH-) )>c(Ba2+)>c(OH-) |
您最近一年使用:0次
2020-06-23更新
|
1077次组卷
|
3卷引用:专题八 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)
(已下线)专题八 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)内蒙古包头市2020届高三普通高等学校招生全国统一考试(第二次模拟考试)理科综合化学试题内蒙古赤峰二中2020-2021学年高二上学期第二次月考化学试题



