解题方法
1 . 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知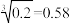 )。下列分析正确的是
)。下列分析正确的是

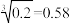 )。下列分析正确的是
)。下列分析正确的是
A.由图可知常温下 |
| B.饱和Ca(OH)2溶液中加入少量CaO,溶液变浑浊,但Ca2+离子数目不变 |
C.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: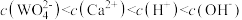 |
| D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液组成沿da线向c点移动(假设混合后溶液体积不变) |
您最近一年使用:0次
名校
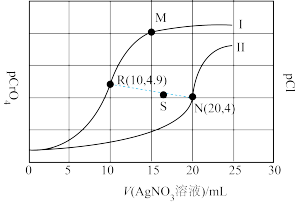
2 . 某温度下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的KCl溶液和K2CrO4溶液中滴加0.1 mol·L-1的AgNO3溶液,滴加过程中pCl和pCrO4随加入AgNO3溶液的体积(V)的变化关系如图所示。已知:pCl=-lgc(Cl-),pCrO4=-lgc( )。下列说法不正确的是
)。下列说法不正确的是
 )。下列说法不正确的是
)。下列说法不正确的是
| A.曲线I表示pCl与V(AgNO3溶液)的变化关系 |
| B.若仅增大KCl的浓度,平衡点由R点沿虚线移向S点 |
C.M点溶液中:c( )>c(Ag+)>c(H+)>c(OH-) )>c(Ag+)>c(H+)>c(OH-) |
| D.该温度下,Ksp(Ag2CrO4)=4.0×10-12 |
您最近一年使用:0次
2021-04-06更新
|
1192次组卷
|
6卷引用:押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)安徽省舒城中学2021-2022学年高二下学期第一次月考化学试题
3 . 某温度下, 的溶解平衡曲线如图,下列说法错误的是
的溶解平衡曲线如图,下列说法错误的是
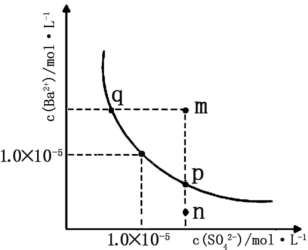
 的溶解平衡曲线如图,下列说法错误的是
的溶解平衡曲线如图,下列说法错误的是
A.该温度下 的溶度积 的溶度积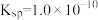 | B.m点有 沉淀析出 沉淀析出 |
C.加入 固体可使n点移动到p点 固体可使n点移动到p点 | D.升高温度可使p点移动到q点 |
您最近一年使用:0次
4 . 硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:

已知:i.PbCl2难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)⇌PbCl (aq) △H>0
(aq) △H>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为_______ ,加入NaCl的目的是_______ 。
(2)沉降操作时加入冰水的作用是_______ 。
(3)20°C时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g•L-1)如图所示。下列叙述正确的是_______ (填字母)
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C当盐酸浓度为1mol•L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol•L-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_______ ,PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c( )=
)=_______ 。
(5)滤液a经过处理后可以返回到_______ 工序循环使用

已知:i.PbCl2难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)⇌PbCl
 (aq) △H>0
(aq) △H>0iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为
(2)沉降操作时加入冰水的作用是
(3)20°C时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g•L-1)如图所示。下列叙述正确的是

A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C当盐酸浓度为1mol•L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol•L-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是
 )=
)=(5)滤液a经过处理后可以返回到
您最近一年使用:0次
解题方法
5 . 大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO 浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO
浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq)
(aq)+H2O(aq)  2HCO
2HCO (aq),下列说法不正确的是
(aq),下列说法不正确的是
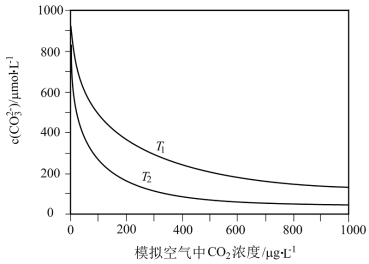
 浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO
浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq)
(aq)+H2O(aq)  2HCO
2HCO (aq),下列说法不正确的是
(aq),下列说法不正确的是
| A.T1>T2 |
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO 浓度降低 浓度降低 |
C.当大气中CO2浓度确定时,海水温度越高,CO 浓度越低 浓度越低 |
| D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解 |
您最近一年使用:0次
2021-03-13更新
|
409次组卷
|
6卷引用:解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第5讲 难溶电解质的溶解平衡浙江省绍兴市柯桥区2020届高三上学期1月模拟普通高校招生考试化学试题浙江省绍兴市柯桥区2021-2022 学年高三下学期选考科目6月适应性考试化学试题安徽省蚌埠四校2021-2022学年高三下学期三模化学试题
6 . 一种从阳极泥(主要成分为 Cu、Ag、Pt、Au、Ag2Se和Cu2S等)中回收 Se和贵重金属的工艺流程如下图所示。
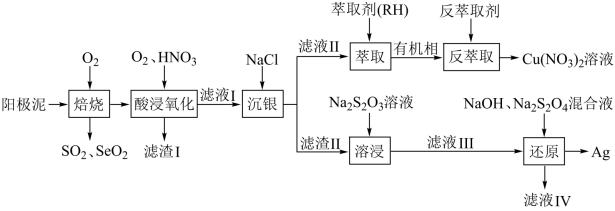
已知:①该工艺中萃取与反萃取原理为: ;
;
② 易与 Ag+形成配离子:
易与 Ag+形成配离子: ,常温下该反应的平衡常数
,常温下该反应的平衡常数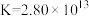 。
。
回答下列问题:
(1)“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为_______ 。
(2)“滤渣Ⅰ”的主要成分是_______ ;“酸浸氧化”中通入氧气的目的是_______ 。
(3)“反萃取剂”最好选用_______ (填化学式)溶液。
(4)“溶浸”中发生的反应为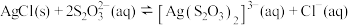 ,该反应的平衡常数K'=
,该反应的平衡常数K'=_______ 。[已知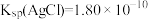 ]
]
(5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程式为_______ ;“滤液 IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是_______ (试用平衡原理解释)。

已知:①该工艺中萃取与反萃取原理为:
 ;
;②
 易与 Ag+形成配离子:
易与 Ag+形成配离子: ,常温下该反应的平衡常数
,常温下该反应的平衡常数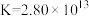 。
。回答下列问题:
(1)“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为
(2)“滤渣Ⅰ”的主要成分是
(3)“反萃取剂”最好选用
(4)“溶浸”中发生的反应为
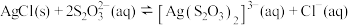 ,该反应的平衡常数K'=
,该反应的平衡常数K'=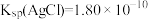 ]
](5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程式为
您最近一年使用:0次
2021-03-11更新
|
780次组卷
|
3卷引用:专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】
(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省临沂市2021届高三第一次模拟考试化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题
7 . 研究含铅废水的处理具有重要意义。向含 Pb2+的废水中逐滴滴加 NaOH溶液,溶液变浑浊,继续滴加 NaOH 溶液又变澄清。溶液中 Pb2+及其与 OH-形成的微粒的浓度分数(α)随溶液 pH 变化的关系如图所示。下列说法正确的是
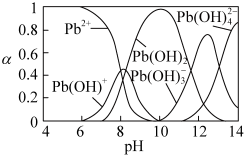
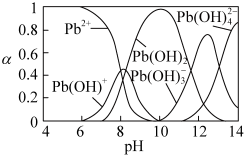
| A.Pb2+的浓度分数先减小后增大 |
| B.除去溶液中的 Pb2+,应将溶液的pH调至约为10 |
| C.pH=7时,溶液中的阳离子仅有Pb2+和Pb(OH)+ |
D.pH≥13 时,溶液中发生的主要反应为: |
您最近一年使用:0次
2021-03-11更新
|
823次组卷
|
3卷引用:专题10 水溶液中的离子平衡-备战2022年高考化学真题及地市好题专项集训【山东专用】
(已下线)专题10 水溶液中的离子平衡-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省临沂市2021届高三第一次模拟考试化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题
名校
解题方法
8 . MSO4和MCO3是两种难溶性盐。常温时两种物质的溶解度曲线如图所示,下列叙述错误的是
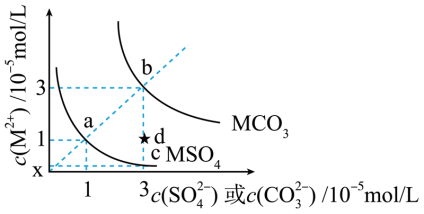
| A.Ksp(MCO3)=9.0×10−10 |
| B.c点的纵坐标0.33 |
| C.在饱和的MCO3澄清溶液里加入适量的Na2SO4固体,可使b点变为d点 |
| D.使1L含1molMSO4的悬浊液中的分散质完全转化为MCO3,需要加1molNa2CO3固体 |
您最近一年使用:0次
2021-03-03更新
|
902次组卷
|
7卷引用:押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题
2021高三·全国·专题练习
名校
9 . 将足量BaCO3固体分别加入:①30 mL水;②10 mL 0.2 mol·L-1Na2CO3溶液;③50 mL 0.01 mol·L-1 BaCl2溶液;④100 mL 0.01 mol·L-1盐酸中溶解至溶液饱和。请确定各溶液中c(Ba2+)由大到小的顺序为
| A.①②③④ | B.③④①② |
| C.④③①② | D.②①④③ |
您最近一年使用:0次
2021高三·全国·专题练习
10 . 已知:T ℃时,Ksp(PbS)=1.3×10-24,Ksp(ZnS)=1.0×10-22;当溶液中离子浓度≤10-5 mol·L-1时,表明该离子已除尽。T℃时,下列有关ZnS和PbS的说法不正确的是
| A.ZnS的饱和溶液中,c(Zn2+)=c(S2-)=1.0×10-11 mol·L-1 |
| B.欲将某工业废水中的Pb2+除去,则加入Na2S溶液后应保证溶液中c(S2-)≥1.3×10-19mol·L-1 |
| C.向同浓度的ZnCl2和PbCl2的混合溶液中滴加Na2S溶液,PbS先析出 |
| D.向PbS悬浊液中加入ZnCl2浓溶液,PbS不可能转化为ZnS |
您最近一年使用:0次



