名校
1 . 下列有关实验操作和结论均正确的是
| 选项 | 操作 | 结论 |
| A | 配制FeCl2溶液时加入适量的盐酸 | 防止Fe2+氧化 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层 |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的[Ca5(PO4)3OH]转化为 [Ca5(PO4)3F],防止蛀牙 | Ksp[Ca5(PO4)3F]sp[Ca5(PO4)3OH] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-06-06更新
|
444次组卷
|
2卷引用:江西省临川二中2018届高三上学期第九次理综化学训练卷
名校
解题方法
2 . 金属镁性质活泼,能与许多物质反应。
I.某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
(1)实验中,装置依次连按的顺序为A_____ (填字母序号);装置B的作用是______ ;
(2)用来检验N2的实验装置为____ (填字母序号);
(3)设计实验证明:产物中存在Mg3N2、____ ;
Ⅱ.工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为_____ 。
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)_______ ;_______ 。
I.某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
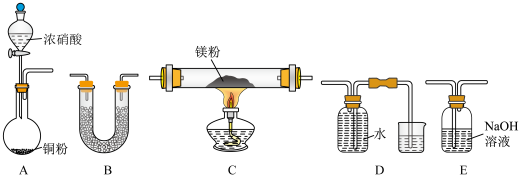
(1)实验中,装置依次连按的顺序为A
(2)用来检验N2的实验装置为
(3)设计实验证明:产物中存在Mg3N2、
Ⅱ.工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)
您最近一年使用:0次
2017-05-05更新
|
306次组卷
|
3卷引用:江西省重点中学盟校2017届高三第二次联考理综化学试题
名校
3 . 下列设计的实验方案能达到相应实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·Lˉ1CuSO4溶液,迅速产生较多气泡 |
C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
D | 通过观察液面差判断该装置的气密性 |  向里推注射器 向里推注射器 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-04-13更新
|
561次组卷
|
3卷引用:2017届江西省南昌市十所省重点中学高三第二次模拟突破冲刺理综试题(三)化学试卷
解题方法
4 . 七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在微生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________ 。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______ (填化学式)。
(3)能否直接控制pH除去Mn2+______ ,理由__________ 。
(4)若检验时溶液呈红色,说明滤液B中还含有_______ 未除尽(填离子符号),应补加_______ 再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________ 。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
| Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
| 开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
| 完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
(1)写出生成H3BO3的离子方程式
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成
(3)能否直接控制pH除去Mn2+
(4)若检验时溶液呈红色,说明滤液B中还含有
(5)沉淀D的化学式
您最近一年使用:0次
5 . 对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| B | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成 | 在相同的温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-03-14更新
|
533次组卷
|
3卷引用:2017届江西省新余市第一中学高三下学期第七次模拟考试理综化学试卷
名校
6 . 室温条件下,下列有关电解质溶液的描述正确的是
A.向Na2CO3溶液中通入CO2至溶液为中性,则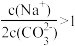 |
B.pH相同的氨水和Ba(OH)2溶液中:2c( )= c( Ba2+) )= c( Ba2+) |
C.等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH-)-c(H+)=c( )+c(H2SO3) )+c(H2SO3) |
D.向Mg(OH)2浊液中加入少量NH4Cl粉末 不变 不变 |
您最近一年使用:0次
2017-03-08更新
|
271次组卷
|
3卷引用:2017届江西省南昌市三校(南昌一中、南昌十中、南铁一中)高三第四次联考理综化学试卷
7 . 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是


| A.根据图①溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量Cu,至pH在4左右。 |
| B.图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
C.图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
D.根据图④可判断可逆反应A2(g)+3B2(g) 2AB3(g)的化学平衡常数K随温度升高而变小 2AB3(g)的化学平衡常数K随温度升高而变小 |
您最近一年使用:0次
2017-02-27更新
|
787次组卷
|
3卷引用:2017届江西省重点中学协作体高三下学期第一次联考理综化学试卷
8 . 下列实验目的对应的实验操作和实验原理均正确的是
| 实验目的 | 实验操作 | 实验原理 | |
| A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+ 2Fe(OH)3+3Mg2+ 2Fe(OH)3+3Mg2+ |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
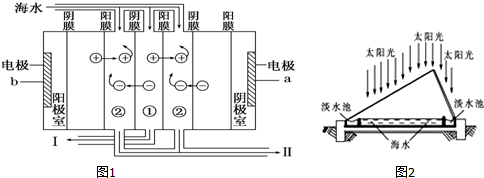
(1)如下图1利用海水得到淡水的方法是____________ ;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________ 极;Ⅰ口排出的是__________ (填“淡水”或“浓水”).
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是_____________ ;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为______________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________ ;
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____ 反应得到的.自来水与该离子交换树脂交换作用后显_________ (填“酸性”、“碱性”或“中性”).

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________ (填阴离子符号)引起的,经___________ (填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的

(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和
 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由
您最近一年使用:0次
13-14高三上·江苏泰州·期末
10 . 下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
您最近一年使用:0次
2016-12-09更新
|
277次组卷
|
5卷引用:2016届江西省南昌二中高三上学期第四次模拟化学试卷
2016届江西省南昌二中高三上学期第四次模拟化学试卷(已下线)2015届江西南昌三中高三11月份月考化学试卷(已下线)2013届江苏省泰州市高三上学期期末考试化学试卷2020届高三化学选修4二轮专题练——沉淀溶解平衡的影响因素及应用【精编23题】(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)



