1 . 下列有关实验操作、现象与结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯加热,熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| B | 向10mL0.1mol•L-1Na2S溶液中滴入2mL0.1mol•L-1ZnSO4溶液,再加入2mL0.1mol•L-1CuSO4溶液,先生成白色沉淀,后生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 充分加热铁粉和硫粉的混合物,冷却后取少量固体于试管中,加入足量稀硫酸,再滴入K3[Fe(CN)6]溶液,产生蓝色沉淀 | 无法充分说明铁被硫氧化至二价铁Fe(Ⅱ) |
| D | 某钾盐晶体中滴入浓盐酸,产生的气体通入品红溶液中,品红溶液褪色 | 产生的气体一定是SO2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 化学与社会、生活密切相关。下列说法不正确的是
| A.打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释 |
| B.纯铁比生铁易生锈 |
| C.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用盐酸除去 |
| D.掩埋废旧电池会造成环境污染 |
您最近一年使用:0次
2023-04-23更新
|
93次组卷
|
3卷引用:江西省宜春市宜丰中学2023届高三模拟预测化学试题
3 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为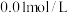 的KCl、
的KCl、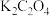 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。下列叙述
的水解)。下列叙述不正确 的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为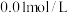 的KCl、
的KCl、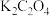 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。下列叙述
的水解)。下列叙述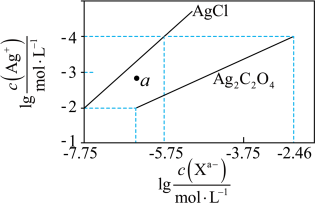
A.计算可得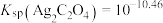 |
| B.a点表示的是AgCl的不饱和溶液 |
C.向 的混合液中滴入 的混合液中滴入 溶液时,先生成AgCl沉淀 溶液时,先生成AgCl沉淀 |
D.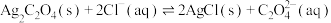 的平衡常数为 的平衡常数为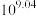 |
您最近一年使用:0次
2023-04-21更新
|
550次组卷
|
5卷引用:江西省宜春市宜丰中学2023届高三模拟预测化学试题
江西省宜春市宜丰中学2023届高三模拟预测化学试题浙江省9+1联盟2022-2023学年高二下学期期中考试化学试题(已下线)【2023】【高二下】【期中考】【9+1联盟】【高中化学】【洪翔峰收集】上海市进才中学2023-2024学年高二下学期3月测试化学试题河北省保定市高碑店市崇德实验中学2023-2024学年高二上学期12月考试化学试题
4 . 根据实验操作、现象得到的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某无色溶液中滴加稀硫酸 | 产生的气体能使品红溶液褪色,加热后溶液又恢复红色 | 原溶液中必含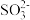 或 或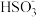 |
| B | 将甲醇和过量酸性高锰酸钾溶液混合 | 紫红色褪去或变浅 | 甲醇被氧化成甲酸 |
| C | 向双氧水中滴加FeCl2溶液 | 起始没有气泡,一段时间后产生大量气泡 | 可能是Fe3+催化了H2O2的分解 |
| D | 向2mL0.lmol·L-1的AgNO3溶液中滴加3滴相同浓度的NaCl溶液,然后再滴加3滴相同浓度的KI溶液 | 先出现白色沉淀,然后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
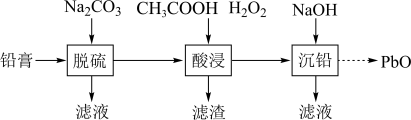
5 . 废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量BaSO4、Fe2O3、Al2O3等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
已知:i.一些难溶电解质的溶度积常数如表:
ii.浓度为0.1mol•L-1的一些金属离子生成氢氧化物沉淀时的pH如表:
回答下列问题:
(1)在“脱硫”中,PbSO4发生转化反应的离子方程式为______ 。
(2)在“酸浸”中,除加入CH3COOH,还要加入H2O2。
①H2O2除了能将Fe(II)转化为Fe(III),还能促进金属Pb在醋酸中转化为(CH3COO)2Pb溶液。H2O2在反应中表现_____ 性。
②H2O2也能使PbO2化为(CH3COO)2Pb溶液,反应中生成的氧化产物是_____ 。(填化学式)
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是______ (写出1条)。
(3)“酸浸”后调节溶液的pH约为4.9,则滤渣的主要成分是______ 。
(4)“沉铅”时,0.1mol/LPb2+在pH=9.1完全沉淀时的浓度是1×10-5mol/L,则Pb(OH)2的Ksp=_____ mol3/L3。

已知:i.一些难溶电解质的溶度积常数如表:
| 难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
| Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Pb(OH)2 |
| 开始沉淀的pH | 1.5 | 6.3 | 3.3 | 7.1 |
| 完全沉淀的pH | 2.8 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中,PbSO4发生转化反应的离子方程式为
(2)在“酸浸”中,除加入CH3COOH,还要加入H2O2。
①H2O2除了能将Fe(II)转化为Fe(III),还能促进金属Pb在醋酸中转化为(CH3COO)2Pb溶液。H2O2在反应中表现
②H2O2也能使PbO2化为(CH3COO)2Pb溶液,反应中生成的氧化产物是
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是
(3)“酸浸”后调节溶液的pH约为4.9,则滤渣的主要成分是
(4)“沉铅”时,0.1mol/LPb2+在pH=9.1完全沉淀时的浓度是1×10-5mol/L,则Pb(OH)2的Ksp=
您最近一年使用:0次
2023-01-13更新
|
227次组卷
|
2卷引用:江西省吉水中学2023届高三下学期一模考试化学试题
6 . 天然水体中的H2CO3与空气中的(CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9,某溶洞水体中lgc(X)(X为H2CO3、 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是

 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是
A.曲线①代表 |
| B.H2CO3的一级电离常数为10-8.3 |
| C.c(Ca2+)随pH升高而增大 |
| D.pH=10.3时,c(Ca2+)=2.8×10-7.9mol·L-1 |
您最近一年使用:0次
2022-12-04更新
|
1323次组卷
|
22卷引用:江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题
江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题辽宁省2021年普通高中学业水平选择考适应性测试化学试题四川省射洪市2021届高考考前模拟测试理综化学试题(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)选择性必修1(SJ)专题3专项拓展训练 水溶液中离子平衡图象分析安徽省示范高中培优联盟20212022学年高二上学期冬季联赛化学试题江苏省南京师范大学附属中学2021-2022学年高三下学期开学考试化学试题 湖南省怀化市通道县第一中学2021-2022学年高三下学期4月月考化学试题第三章水溶液中的离子反应与平衡福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第54讲 水溶液中四大平衡常数的综合应用(已下线)易错点3不会利用“特殊点”解电解质溶液图像题(已下线)题型141 Ksp的相关计算(已下线)T15-溶液中的离子平衡(已下线)第5讲 难溶电解质的溶解平衡黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题辽宁师范大学附属中学2021-2022学年高三上学期阶段测试化学试题重庆市第一中学校2023-2024学年高二上学期第一次月考化学试题(已下线)选择题11-15湖南省邵阳市邵东市创新高级中学2023-2024学年高二上学期创高杯考试化学试题
7 . 向10mL浓度均为0.1mol·L-1的FeSO4和ZnSO4的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水(K b=1.8×10-5)体积关系如图所示,测得M、N点溶液pH分别为8.04、8.95。
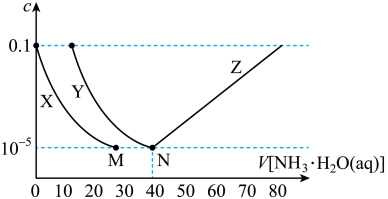
已知:i.Zn2++4NH3 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06
ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是

已知:i.Zn2++4NH3
 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是
| A.曲线X表示Zn2+ |
| B.Ksp[Fe(OH)2]=10-15.1 |
| C.N点锌元素的主要存在形式是[Zn(NH3)4]2+ |
D.Zn(OH)2+4NH3 [Zn(NH3)4]2++2OH- K=10-7.86 [Zn(NH3)4]2++2OH- K=10-7.86 |
您最近一年使用:0次
2022-11-18更新
|
1216次组卷
|
5卷引用:江西省宜春市九校2023届高三下学期第二次联考理科综合化学试题
8 . 下列实验能达到预期目的是
| 选项 | 实验内容 | 实验目的 |
| A | 用pH试纸测试NaClO溶液pH | 证明HClO为弱酸 |
| B | 将SO2通入酸性KMnO4溶液中,溶液褪色 | 证明SO2具有漂白性 |
| C | 向1mL0.01mol/LKCl溶液中滴入2滴0.01mol/LAgNO3溶液,产生白色沉淀,再滴入2滴0.01mol/LKI溶液,又产生黄色沉淀 | 证明在相同温度下,Ksp(AgCl)>Ksp(AgI) |
| D | 某溶液中加入Ba(NO3)2,产生白色沉淀,再加入稀HCl,沉淀不溶解 | 证明原溶液中含SO42- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 无机研究开创绝不无“钴”的时代,草酸钴可用作指示剂和催化剂,CoCl2·6H2O可作为饲料营养强化剂。用某水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、 SiO2等)制取CoC2O4·2H2O及CoCl2·6H2O工艺流程如图所示:
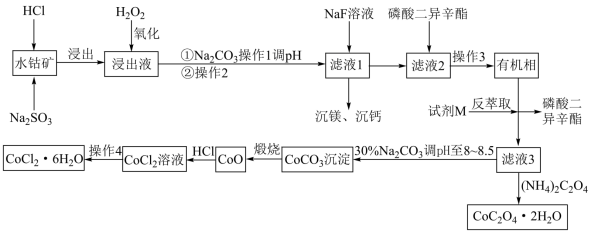
已知:①滤液1含有的阳离子主要有H+、Co2+、Mn2+、Ca2+、 Mg2+等;
②酸性条件下,H2O2不会氧化Co2+;
③该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“浸出”过程中,Co2O3参与反应的离子方程式为_______ 。
(2)“氧化”过程中涉及的反应离子方程式_______ 。
(3)“操作1”调pH的范围为_______ 。
(4)在实验室完成“操作3”需用到的玻璃仪器有_______ 。
(5)“操作4”洗涤过程中可以用工业酒精代替水,其优点是_______ 。
(6)由已知③可知,当Al3+完全沉淀(Al3+浓度为1.0 ×10-5mol·L-1 )时Fe3+的浓度为_______ 。
(7)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是_______(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20°C时的颜色及Ksp值如表:

已知:①滤液1含有的阳离子主要有H+、Co2+、Mn2+、Ca2+、 Mg2+等;
②酸性条件下,H2O2不会氧化Co2+;
③该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Co2+ | Mn2+ |
| 开始沉淀时 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀时 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(1)“浸出”过程中,Co2O3参与反应的离子方程式为
(2)“氧化”过程中涉及的反应离子方程式
(3)“操作1”调pH的范围为
(4)在实验室完成“操作3”需用到的玻璃仪器有
(5)“操作4”洗涤过程中可以用工业酒精代替水,其优点是
(6)由已知③可知,当Al3+完全沉淀(Al3+浓度为1.0 ×10-5mol·L-1 )时Fe3+的浓度为
(7)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是_______(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20°C时的颜色及Ksp值如表:
| 化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
| A.KCl | B.K2CrO4 | C.KSCN | D.K2S |
您最近一年使用:0次
2022-07-07更新
|
512次组卷
|
2卷引用:江西省鹰潭市2022届高三下学期第一次模拟考试理科综合化学试题
解题方法
10 . 下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将HI溶液加入Fe(NO3)3溶液中,充分反应后再加入CCl4混合振荡,静置 | 溶液分层, 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| B | 过量的铁粉和氯气反应,将反应后的固体溶于盐酸后,滴加KSCN溶液 | 溶液不显红色 | 过量铁与氯气反应的产物为FeCl2 |
| C | 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3溶液和CH3COONa溶液的pH | pH:Na2SO3>CH3COONa | H2SO3酸性弱于CH3COOH |
| D | 向2支装有等物质的量的AgCl、AgI的试管中分别滴加足量等体积等浓度的氨水 | AgCl溶解而AgI不溶解 | 相同温度下,Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



