名校
解题方法
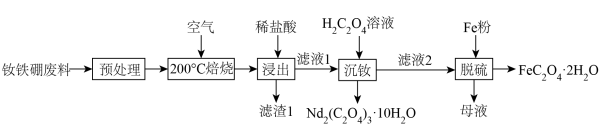
1 . 钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收Nd2(C2O4)3·10H2O和FeC2O4·2H2O的工艺流程如图:
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择___________ (填化学式)溶液。
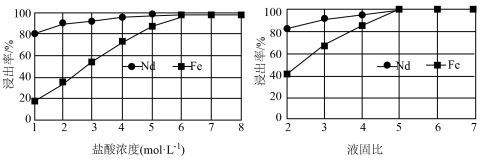
(2)“滤渣1”的主要成分是___________ (填名称)。“浸出”时,盐酸浓度和液固比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是___________ 。___________ 。
(4)“沉铁”时,加入铁粉的作用是___________ 。
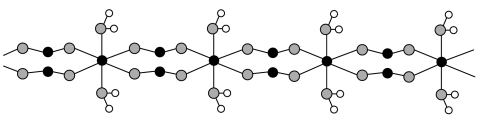
(5)FeC2O4·2H2O晶体结构片段如图所示。___________ ;碳原子采用___________ 杂化。现测定草酸亚铁晶体纯度。准确称取Wg样品于锥形瓶,加入适量的稀硫酸,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液bmL。滴定反应: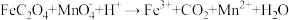 (未配平)。该样品纯度为
(未配平)。该样品纯度为___________ %。
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择
(2)“滤渣1”的主要成分是
(4)“沉铁”时,加入铁粉的作用是
(5)FeC2O4·2H2O晶体结构片段如图所示。
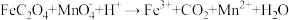 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
2023-11-01更新
|
1047次组卷
|
5卷引用:2024届江西省南昌市第十九中学高三下学期模拟预测化学试题
名校
解题方法
2 . 废旧铅蓄电池会导致铅污染,回收铅的流程如图所示。
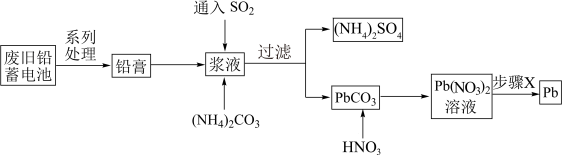
| A.SO2的作用是将PbO2还原成PbSO4 |
B.加入(NH4)2CO3后发生的反应为:PbSO4(s)+CO (aq) (aq) PbCO3(s)+SO PbCO3(s)+SO (aq) (aq) |
| C.步骤X可以是蒸干灼烧 |
| D.若步骤X为电解,则整个流程中,HNO3可循环使用 |
您最近一年使用:0次
2023-09-17更新
|
606次组卷
|
5卷引用:2024届南昌市第十九中学高三下学期模拟预测化学试题
名校
解题方法
3 . 下列实验目的、方案设计和现象、结论都正确的是
| 实验目的 | 方案设计和现象 | 结论 | |
| A | 比较KMnO4、Cl2和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性:KMnO4>Cl2>Fe3+ |
| B | 检验某溶液中是否含有Fe2+ | 取少量待检液于试管中,先滴加KSCN溶液,无明显变化,再滴加新制氯水,变为红色溶液 | 该溶液一定含有Fe2+ |
| C | 比较Ksp(AgCl)、Ksp(AgI)的大小 | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| D | 检验某有机物(如图)中含有醛基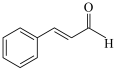 | 取少量待检液于试管中,滴加酸性KMnO4溶液,紫红色褪去 | 该有机物中含有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
1195次组卷
|
3卷引用:江西省上饶市2024届高三下学期第一次高考模拟考试化学试题
江西省上饶市2024届高三下学期第一次高考模拟考试化学试题广西壮族自治区南宁三中、柳州高中2023-2024学年高三上学期第一次适应性考试化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
4 . 银量法滴定产生的废液、废渣中含有AgSCN、AgI等,工业上常以这些废料、废渣为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如图:
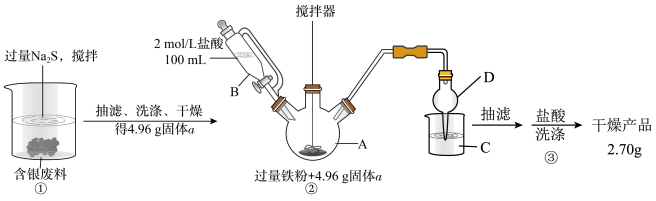
请回答下列问题:
(1)步骤①中AgSCN与Na2S反应的离子方程式为___________ ,获得沉淀时要多搅拌一段时间以获取团聚的沉淀物,该操作对后续处理的意义是___________ 。
(2)仪器B相较于分液漏斗的优点为___________ 。
(3)仪器A中物质在搅拌下充分反应后,溶液呈现浅绿色,伴有黑色不溶物产生,并生成臭鸡蛋气味气体,写出该反应的化学方程式___________ 。
(4)步骤②产生的尾气可用C装置盛装CuSO4溶液吸收,写出该反应的化学方程式___________ 。
(5)步骤③若采用稀HNO3洗涤,则产品回收率___________ (填“偏高”“偏低”或“无影响”)
(6)利用实验中给出的数据计算本次实验从固体a获得银单质的回收率为___________ 。(保留三位有效数字)

请回答下列问题:
(1)步骤①中AgSCN与Na2S反应的离子方程式为
(2)仪器B相较于分液漏斗的优点为
(3)仪器A中物质在搅拌下充分反应后,溶液呈现浅绿色,伴有黑色不溶物产生,并生成臭鸡蛋气味气体,写出该反应的化学方程式
(4)步骤②产生的尾气可用C装置盛装CuSO4溶液吸收,写出该反应的化学方程式
(5)步骤③若采用稀HNO3洗涤,则产品回收率
(6)利用实验中给出的数据计算本次实验从固体a获得银单质的回收率为
您最近一年使用:0次
解题方法
5 . 能正确表示下列变化的离子方程式是
A.乙醇与KMnO4酸性溶液反应:5CH3CH2OH+4 + 12H+→5CH3COO-+5H++4Mn2++11H2O + 12H+→5CH3COO-+5H++4Mn2++11H2O |
B.0.1mol ·L-1 AgNO3溶液中加入过量浓氨水:Ag++3NH3·H2O=Ag(NH3)2OH+2H2O+ |
| C.少量Mg(OH)2溶于FeCl3 溶液:3Mg(OH)2(s)+2Fe3+(aq) =2Fe(OH)3(s)+3Mg2+(aq) |
| D.H2l8O 中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
您最近一年使用:0次
6 . 工业上利用炼锌矿渣[含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4等铁的化合物]获得3种金属盐,并进一步制备半导体材料氮化镓GaN,部分工艺流程如图:
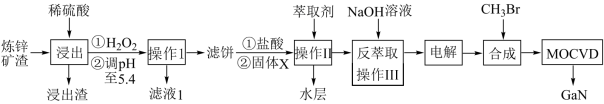
已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
②镓的化学性质与铝相似;
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为_______ , 浸取前需对矿渣粉碎的目的是_______ 。
(2)“浸出”后①中加入H2O2的离子方程式为_______ 。
(3)处理浸出液时,调节pH至5.4的目的是_______ 。
(4)萃取前,加入的固体X为_______ (填化学式)。
(5)反萃取后,镓元素的存在形式为_______ (填化学式)。
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为_______ 。
(7)滤液1中残留的镓离子的浓度为_______ mol·L-l。

已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.8 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为
(2)“浸出”后①中加入H2O2的离子方程式为
(3)处理浸出液时,调节pH至5.4的目的是
(4)萃取前,加入的固体X为
(5)反萃取后,镓元素的存在形式为
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为
(7)滤液1中残留的镓离子的浓度为
您最近一年使用:0次
7 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验现象 | 结论 |
| A | 比较元素的非金属性 | 向饱和的硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液,无气泡冒出 | 非金属性:C>B |
| B | 比较KMnO4、Cl2 和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性: KMnO4> Cl2> Fe3+ |
| C | 向1 mL 0.1 mol·L-1的MgCl2溶液中滴加2mL0.2mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 白色沉淀转化成红褐色沉淀 | Ksp[Mg(OH)2]> Ksp[(Fe(OH)3] |
| D | 检验溶液中是否含有钠元素 | 用玻璃棒蘸取该溶液在酒精灯外焰上灼烧,火焰呈黄色 | 该溶液中含有钠元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 下列实验过程能达到探究目的的是
| 选项 | 实验过程 | 探究目的 |
| A | 检验Na2SO3中是否混有Na2CO3 | 取少量固体,滴加稀盐酸,观察是否有气体生成 |
| B | 向20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液,无明显现象 | 蔗糖未发生水解反应 |
| C | 苯和液溴的混合液中加入铁粉,将产生的气体通入硝酸酸化的AgNO3溶液中,产生淡黄色沉淀 | 证明苯与液溴在Fe催化下发生取代反应 |
| D | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 已知: 、
、 在水溶液中的溶解平衡分别为
在水溶液中的溶解平衡分别为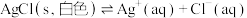 、
、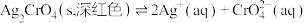 。常温下,分别向
。常温下,分别向 等浓度的
等浓度的 溶液和
溶液和 溶液中滴加等浓度的
溶液中滴加等浓度的 溶液,所加硝酸银溶液的体积与阴离子的浓度关系如图所示。下列说法错误的是
溶液,所加硝酸银溶液的体积与阴离子的浓度关系如图所示。下列说法错误的是
 、
、 在水溶液中的溶解平衡分别为
在水溶液中的溶解平衡分别为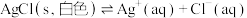 、
、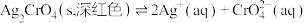 。常温下,分别向
。常温下,分别向 等浓度的
等浓度的 溶液和
溶液和 溶液中滴加等浓度的
溶液中滴加等浓度的 溶液,所加硝酸银溶液的体积与阴离子的浓度关系如图所示。下列说法错误的是
溶液,所加硝酸银溶液的体积与阴离子的浓度关系如图所示。下列说法错误的是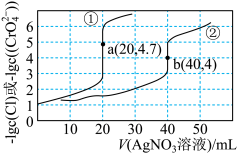
A.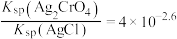 |
B. 与 与 溶液反应对应曲线② 溶液反应对应曲线② |
C. 可作为 可作为 溶液标定 溶液标定 溶液浓度的指示剂 溶液浓度的指示剂 |
D.欲使图中a点或b点向左平移可增大 溶液的浓度 溶液的浓度 |
您最近一年使用:0次
2023-05-11更新
|
138次组卷
|
2卷引用:2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
名校
解题方法
10 . 已知:室温下氢硫酸 的电离常数
的电离常数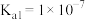 ,
,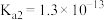 ;
; 和
和 的
的 分别为
分别为 、
、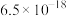 ,下列说法不正确的是
,下列说法不正确的是
 的电离常数
的电离常数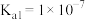 ,
,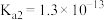 ;
; 和
和 的
的 分别为
分别为 、
、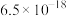 ,下列说法不正确的是
,下列说法不正确的是A.反应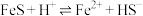 的平衡常数 的平衡常数 的数值为 的数值为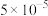 |
B.可以用 除去污水中的 除去污水中的 |
C.从上述数据可得出 难溶于稀硫酸中 难溶于稀硫酸中 |
D. 的 的 溶液中加入等体积 溶液中加入等体积 的 的 溶液,则有: 溶液,则有: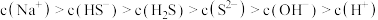 |
您最近一年使用:0次
2023-05-06更新
|
634次组卷
|
3卷引用:江西省鹰潭市余江区第一中学2023-2024学年高三下学期二模考试化学试题



